中心导管(central line,CL)是临床用于抢救危重患者的重要通道,中心导管相关性血流感染(central line-associated bloodstream infection, CLABSI)是指患者留置中心导管期间或拔除中心导管48 h内发生的原发性的、与其他部位存在感染无关的血流感染[1]。CLABSI是中心静脉置管的一种常见并发症,据统计,美国重症监护病房(ICU)每年的中心静脉置管日达1500万日,ICU每年发生CLABSI约8万例,在整个医院范围内,预计每年发生病例数可高达25万例[2]。中心导管感染可在一定程度上影响患者疾病的治疗效果,并直接导致患者住院费用的增加和住院时间的延长[2-4],因此,采取一种安全有效的措施来预防CLABSI的发生是十分重要的。近年来,抗生素封管对预防CLABSI的发生是否安全有效这一问题一直备受争议。美国传染病学会在2009年更新的《血管内导管相关感染的诊断和管理临床实践指南》中提出应使用抗生素锁定疗法进行导管维护[5];美国CDC于2011 年发布的《导管相关性血流感染的预防控制指南》中也提出对于虽然已最大程度地执行无菌操作,但仍有多次导管相关性血流感染(catheter-related bloodstream infection, CRBSI)史的长期置管患者,可使用抗菌药物溶液进行封管(Ⅱ类)[6];而国内中华医学会重症医学分会于2007制定的《血管内导管相关感染的预防与治疗指南》中则提出,使用抗生素封管有导致耐药菌出现的危险,不予推荐[7]。近年来针对抗生素封管预防CLABSI发生的研究大多样本量较少且研究结论各异,因此有必要对抗生素封管作为CLABSI预防措施是否安全有效这一问题进行系统分析。本研究通过收集国内外有关抗生素封管预防CLABSI发生的随机对照试验,采用Meta分析的方法对抗生素封管的有效性和安全性进行综合评价,以期为临床实践提供科学依据。
1 资料与方法
1.1 纳入标准 (1)研究设计随机对照试验(RCT);(2)研究对象留置中心导管的人群,不对年龄、导管类型及导管留置时间进行限制;(3)研究类型纳入将单一或组合抗生素溶液与其他封管溶液进行比较的随机对照试验,不限制抗生素种类。(4)结局指标:主要结局指标为CRBSI的发生率(例次发生率);次要结局指标包括导管出口部位感染发生率、导管病原菌定植率、血栓发生率、全因死亡率等。
1.2 排除标准 (1)非中、英文的文献;(2)数据不完整或无法获取全文,无法提取数据的文献;(3)重复发表的文献;(4)未提供明确的CRBSI的诊断判定标准的文献;(5)已确诊中心导管感染后使用抗生素封管进行治疗的研究。
1.3 检索策略 计算机检索PubMed、Embase、CENTRAL (Cochrane Central Register of Controlled Trails)、中国生物医学文献数据库(CBM)、中国期刊全文数据库(CNKI)、中国科技期刊全文数据库(VIP)和万方数据库,检索时限为建库至2018年7月。采用主题词与自由词相结合的方式,根据PICOS原则制定检索式,并追踪相关文献的参考文献以达到全面检索的目的。英文检索词主要包括:“central venous catheters” /“central vein line”/“central venous line” /“peripherally inserted central catheters”/“CVL”/“CVC”/“PICC”/“anti-bacterial agents”/“anti-bacterial compounds”/“bacteriocides”/“antibiotics”/“infection”/“sepsis”/“catheter-related infections”/“catheter-related bacteraemia”/ “CLABSI” / “CRBSI” /“CRB” /“CRI”等;中文检索词包括:中心导管/中心静脉导管/经外周静脉置入中心静脉导管/抗生素锁定/抗生素封管/感染/菌血症/导管相关感染/导管相关性血流感染/导管相关性菌血症等。具体检索策略见表1。
表1 检索策略

数据库检索策略PubMed#1 Search ((((((((((((((((((((((central venous catheters[Title/Abstract]) OR Catheter, Central Venous[Title/Abstract]) OR Catheters, Central Venous[Title/Abstract]) OR Venous Catheter, Central[Title/Abstract]) OR Venous Catheters, Central[Title/Abstract]) OR Central Venous Catheter[Title/Abstract]) OR CVC[Title/Abstract]) OR Central vein line[Title/Abstract]) OR central venous line[Ti-tle/Abstract]) OR CVL[Title/Abstract]) OR catheterization, central venous[Title/Abstract]) OR peripherally inserted central catheters[Ti-tle/Abstract]) OR PICC[Title/Abstract]) OR Catheterization, Central Venous[Title/Abstract]) OR Venous Catheterization, Central[Title/Abstract]) OR Central Catheterization[Title/Abstract]) OR Catheterization, Central[Title/Abstract]) OR Catheterizations, Central[Title/Abstract]) OR Central Catheterizations[Title/Abstract]) OR Central Venous Catheterization[Title/Abstract]) OR Catheterizations, Central Venous[Title/Abstract]) OR Central Venous Catheterizations[Title/Abstract]) OR Venous Catheterizations, Central[Title/Abstract]#2 Search ((((((((((((((((((((Anti-Bacterial Agents[Title/Abstract]) OR Agents, Anti-Bacterial[Title/Abstract]) OR Anti Bacte-rial Agents[Title/Abstract]) OR Antibacterial Agents[Title/Abstract]) OR Agents, Antibacterial[Title/Abstract]) OR Anti-Bacterial Com-pounds[Title/Abstract]) OR Anti Bacterial Compounds[Title/Abstract]) OR Compounds, Anti-Bacterial[Title/Abstract]) OR Bacteriocidal Agents[Title/Abstract]) OR Agents, Bacteriocidal[Title/Abstract]) OR Bacteriocides[Title/Abstract]) OR Anti-Mycobacterial Agents[Ti-tle/Abstract]) OR Agents, Anti-Mycobacterial[Title/Abstract]) OR Anti Mycobacterial Agents[Title/Abstract]) OR Antimycobacterial A-gents[Title/Abstract]) OR Agents, Antimycobacterial[Title/Abstract]) OR Antibiotics[Title/Abstract]) OR Antibiotic[Title/Abstract]) OR bacteremia[Title/Abstract]) OR antimicrobial[Title/Abstract]) OR antibiotic lock[Title/Abstract]#3 Search ((((((((infection[Title/Abstract]) OR sepsis[Title/Abstract]) OR catheter-related bacteraemia[Title/Abstract]) OR catheter-related infections[Title/Abstract]) OR bloodstream infection[Title/Abstract]) OR CLABSI[Title/Abstract]) OR CRBSI[Title/Abstract]) OR CRB[Title/Abstract]) OR CRI[Title/Abstract]#4 Search (randomized controlled trial [pt] OR controlled clinical trial [pt] OR randomized [tiab] OR placebo [tiab] OR clinical trials as topic [mesh: noexp] OR randomly [tiab] OR trial [ti]) NOT (animals [mh] NOT humans [mh])#5 #1 AND #2 AND #3 AND #4Embase#1 central venous catheter/exp#2 nontunneled central venous catheter:ab,ti ORperipherally inserted central venous catheter:ab,ti ORsubclavian vein catheter:ab,ti#3 #1 OR #2#4 antibiotic agent/exp#5 catheter infection/exp#6 random∗ OR blind∗ OR placebo ORmeta analysis#7 #3 AND #4 AND #5 AND #6
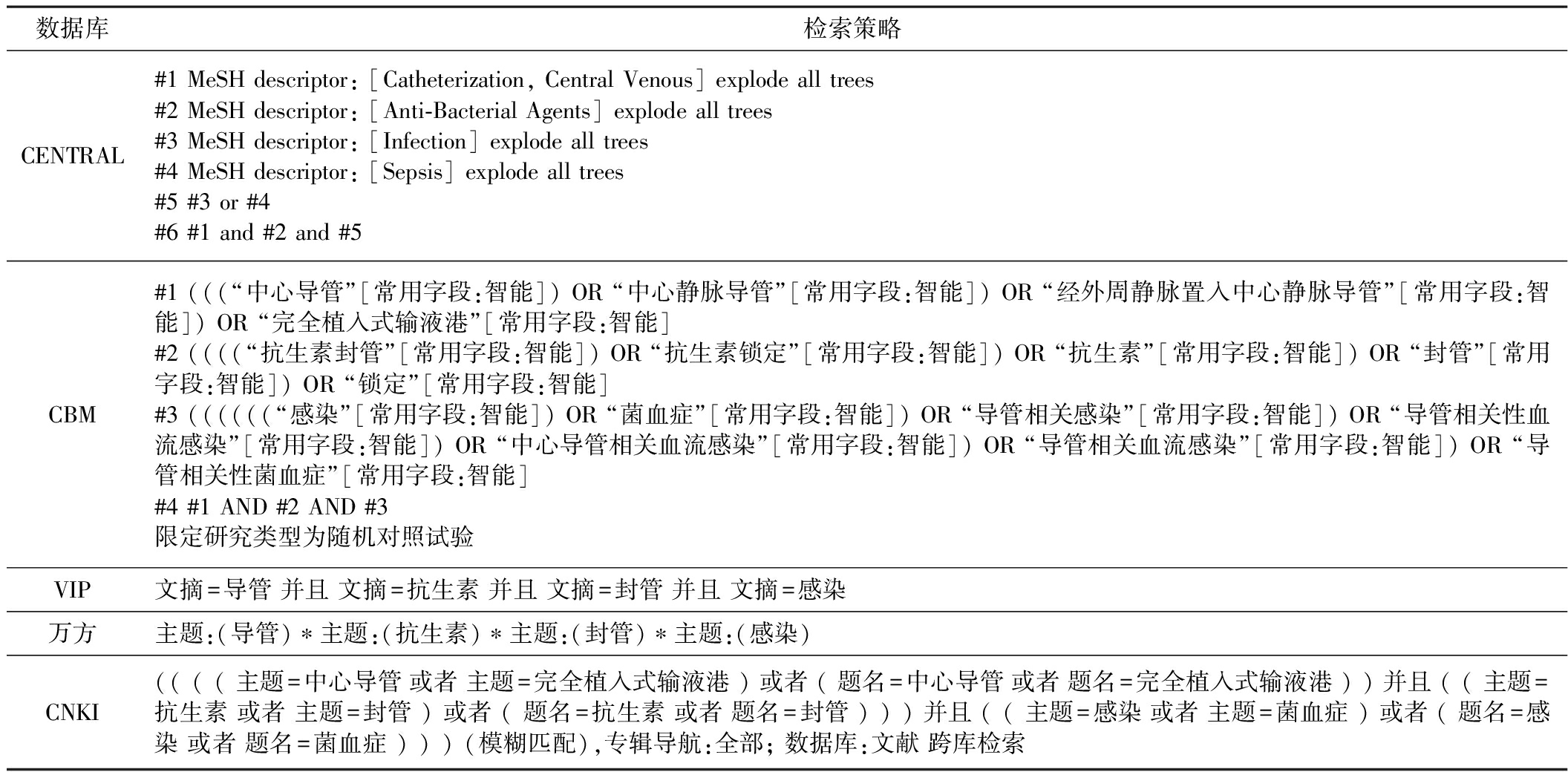
数据库检索策略CENTRAL#1 MeSH descriptor: [Catheterization, Central Venous] explode all trees#2 MeSH descriptor: [Anti-Bacterial Agents] explode all trees#3 MeSH descriptor: [Infection] explode all trees#4 MeSH descriptor: [Sepsis] explode all trees#5 #3 or #4#6 #1 and #2 and #5CBM#1 (((“中心导管”[常用字段:智能]) OR “中心静脉导管”[常用字段:智能]) OR “经外周静脉置入中心静脉导管”[常用字段:智能]) OR “完全植入式输液港”[常用字段:智能]#2 ((((“抗生素封管”[常用字段:智能]) OR “抗生素锁定”[常用字段:智能]) OR “抗生素”[常用字段:智能]) OR “封管”[常用字段:智能]) OR “锁定”[常用字段:智能]#3 ((((((“感染”[常用字段:智能]) OR “菌血症”[常用字段:智能]) OR “导管相关感染”[常用字段:智能]) OR “导管相关性血流感染”[常用字段:智能]) OR “中心导管相关血流感染”[常用字段:智能]) OR “导管相关血流感染”[常用字段:智能]) OR “导管相关性菌血症”[常用字段:智能]#4 #1 AND #2 AND #3限定研究类型为随机对照试验VIP文摘=导管 并且 文摘=抗生素 并且 文摘=封管 并且 文摘=感染万方主题:(导管)∗主题:(抗生素)∗主题:(封管)∗主题:(感染)CNKI(( ( ( 主题=中心导管 或者 主题=完全植入式输液港 ) 或者 ( 题名=中心导管 或者 题名=完全植入式输液港 ) ) 并且 ( ( 主题=抗生素 或者 主题=封管 ) 或者 ( 题名=抗生素 或者 题名=封管 ) ) ) 并且 ( ( 主题=感染 或者 主题=菌血症 ) 或者 ( 题名=感染 或者 题名=菌血症 ) ) ) (模糊匹配),专辑导航:全部; 数据库:文献 跨库检索
1.4 文献筛选和数据提取 由两名研究者按照研究的纳入及排除标准独立进行文献筛选并进行交叉核对,如遇分歧,则通过两人协商或由第三方协助进行裁定。提取内容如下:(1)纳入文献的基本信息:一作姓名、发表时间、题名、语言及发表期刊;(2)研究对象的基本特征、研究样本量、干预措施的具体实施情况、结局指标。若文献未给出具体数据,则认定为数据缺失,未对数据进行估计和猜测。
1.5 文献质量评价 由两名研究者根据Cochrane系统评价手册(Version 5.1.0)[8]提供的偏倚风险评估工具对所纳入研究独立进行偏倚风险评价,并进行交叉核对,如遇分歧,则两人协商或由第三方协助进行裁定。评价内容包括以下几个方面:(1)随机序列的生成;(2)分配隐藏;(3)对受试者、试验人员实施盲法;(4)对结局评估员施盲;(5)结果数据不完整;(6)选择性报告结果;(7)偏倚的其他来源。
1.6 统计学方法 采用RevMan 5.3软件进行Meta分析。使用漏斗图进行发表偏倚检测,选用相对危险度(RR)作为效应指标。通过χ2检验分析(检验水准为α=0.1)结合I2值判断文章结果间是否存在异质性。若P>0.1,I2≤50%,则认为各研究间具有同质性,采用固定效应模型进行Meta分析;若P≤0.1,I2>50%,则认为各研究间具有异质性,采用随机效应模型进行Meta分析,并通过敏感性分析对异质性来源进行分析。Meta分析的检验水准为α=0.05。
2 结 果
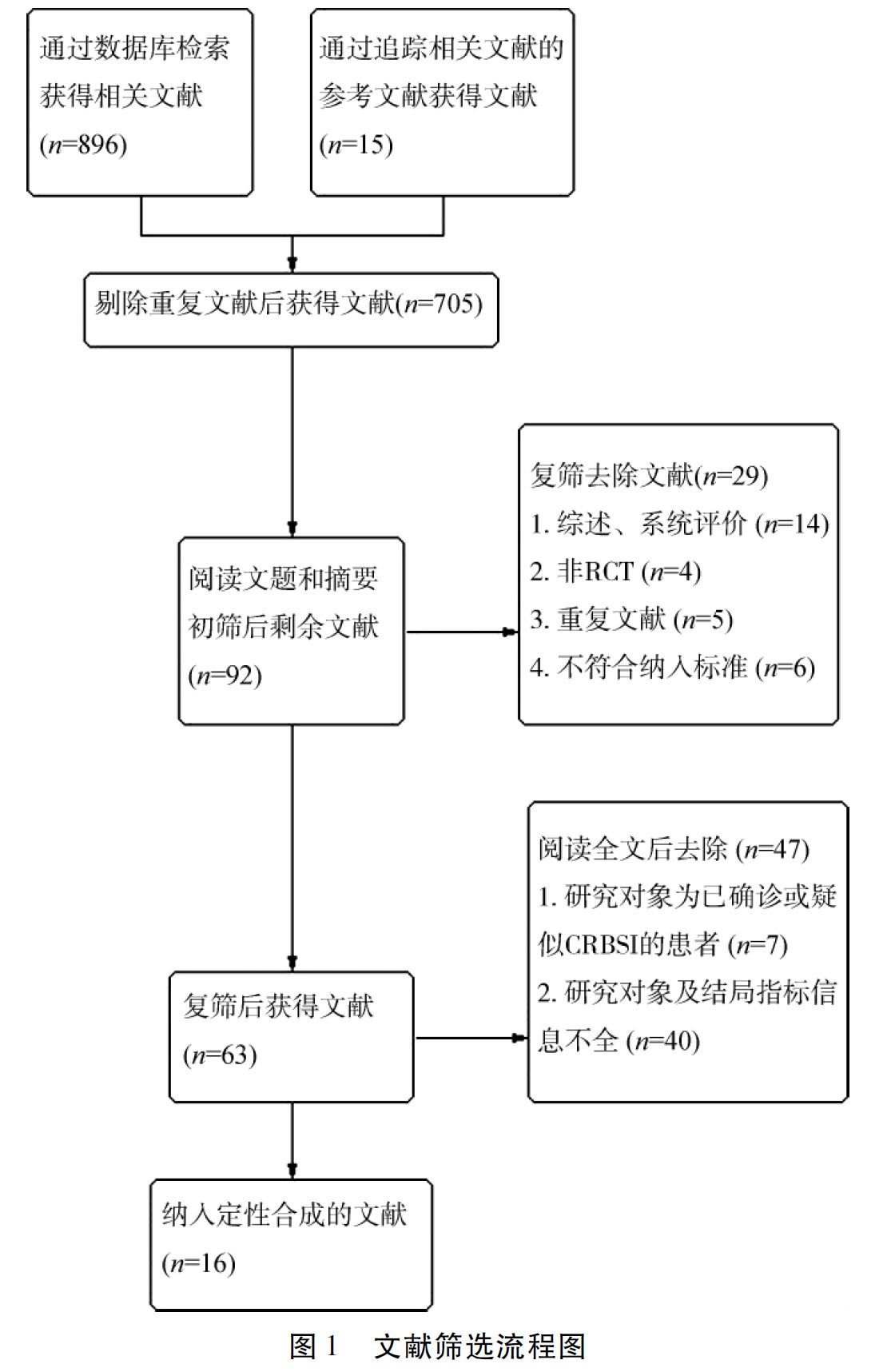
2.1 文献检索流程及结果 文献检索及筛选流程见图1。
2.2 纳入研究的基本特征 共纳入16项研究,其中英文文献13篇,中文文献3篇。治疗组采用单纯或混合的抗生素溶液进行封管,对照组则均采用肝素溶液。其中15篇文献报告了研究对象的CRBSI感染率(例次发生率),6项研究报告了研究对象导管出口部位的感染情况,8项研究报告了导管病原菌定植情况,4项研究报告了血栓形成情况,5项研究报告了全因死亡情况。治疗组使用单纯或混合的抗生素溶液进行封管,对照组则均采用肝素溶液。见表2。
表2 纳入文献的基本特征
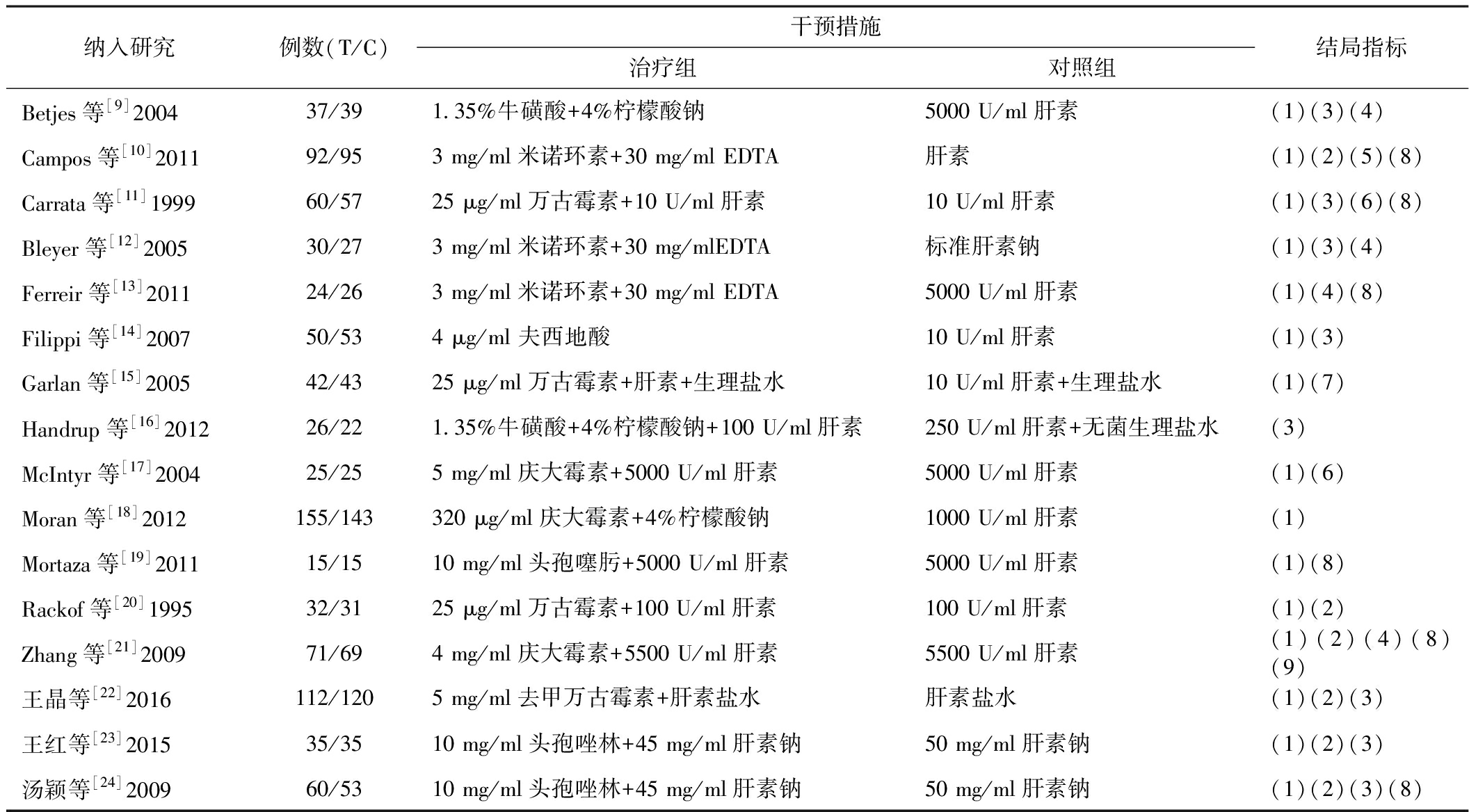
纳入研究例数(T/C)干预措施治疗组对照组结局指标Betjes等[9]200437/391.35%牛磺酸+4%柠檬酸钠5000 U/ml肝素(1)(3)(4)Campos等[10]2011 92/953 mg/ml米诺环素+30 mg/ml EDTA肝素(1)(2)(5)(8)Carrata等[11]199960/5725 μg/ml万古霉素+10 U/ml肝素10 U/ml肝素(1)(3)(6)(8)Bleyer等[12]200530/273 mg/ml米诺环素+30 mg/mlEDTA标准肝素钠(1)(3)(4)Ferreir等[13]201124/263 mg/ml米诺环素+30 mg/ml EDTA5000 U/ml肝素(1)(4)(8)Filippi等[14]200750/534 μg/ml 夫西地酸10 U/ml肝素(1)(3)Garlan等[15]200542/4325 μg/ml万古霉素+肝素+生理盐水10 U/ml肝素+生理盐水(1)(7)Handrup等[16]201226/221.35%牛磺酸+4%柠檬酸钠+100 U/ml肝素250 U/ml肝素+无菌生理盐水(3)McIntyr等[17]200425/255 mg/ml庆大霉素+5000 U/ml肝素5000 U/ml肝素(1)(6)Moran等[18]2012155/143320 μg/ml庆大霉素+4%柠檬酸钠1000 U/ml肝素(1)Mortaza等[19]201115/1510 mg/ml头孢噻肟+5000 U/ml肝素 5000 U/ml肝素(1)(8)Rackof等[20]199532/3125 μg/ml万古霉素+100 U/ml肝素100 U/ml肝素(1)(2)Zhang等[21]200971/694 mg/ml庆大霉素+5500 U/ml肝素5500 U/ml肝素(1)(2)(4)(8)(9)王晶等[22]2016112/1205 mg/ml去甲万古霉素+肝素盐水肝素盐水(1)(2)(3)王红等[23]201535/3510 mg/ml头孢唑林+45 mg/ml肝素钠50 mg/ml肝素钠(1)(2)(3)汤颖等[24]200960/5310 mg/ml头孢唑林+45 mg/ml肝素钠50 mg/ml肝素钠(1)(2)(3)(8)
注:T:试验组;C:对照组;(1)CRBSI;(2)导管出口部位感染;(3)导管病原菌定植;(4)血栓;(5)导管功能障碍;(6)导管阻塞;(7)血糖水平改变;(8)全因死亡;(9)其余不良反应
2.1 纳入研究的质量评价 采用Cochrane系统评价手册(Version 5.1.0)提供的偏倚风险评估工具,对所纳入研究进行偏倚风险评价,结果显示:15项研究[9-22, 24]描述了随机序列的具体产生方法,6项研究[11-13, 15, 17, 21]描述了分配隐藏的方案,4项研究[11-12, 15, 21]描述了盲法的实施方案。
2.2 发表偏倚评价 对主要指标CRBSI发生率进行漏斗图分析,结果显示漏斗图左右两侧分布不对称,提示可能存在发表偏倚。
2.3 Meta分析结果
2.3.1 CRBSI发生率 共纳入15项研究,各研究间无异质性(I2=28%,P=0.15),应用固定效应模型。Meta分析结果显示:治疗组CRBSI发生率低于对照组,差异有统计学意义[RR=0.31,95%CI(0.23,0.42),P<0.00001] 。
2.3.2 导管出口部位感染发生率 共纳入6项研究,各研究间无异质性(I2=0%,P=0.77),应用固定效应模型。Meta分析结果显示,治疗组与对照组导管出口部位发生率相比,差异无统计学意义[RR=0.81,95%CI(0.42,1.56),P=0.52]。
2.3.3 导管病原菌定植率 共纳入8项研究,但研究间存在异质性(I2=84,P<0.00001),应用随机效应模型,并采用敏感性分析探索异质性来源,敏感性分析结果显示,剔除Handrup等[16]的研究后,异质性可接受(I2=24%,P=0.25)。通过仔细阅读和对比纳入研究的特征后发现,Handrup等[16]的研究在进行导管病原菌定植的检测时运用了扫描电镜显微术(SEM),而其余几项研究则均采用了血液培养或无菌拭子培养等方法进行导管病原菌的测定,提示病原菌的检测方法可能为异质性的来源。剔除Handrup等[16]的研究后,Meta分析结果显示,治疗组导管病原菌定植率低于对照组,差异有统计学意义[RR=0.23,95%CI(0.10,0.52),P=0.0004]。
2.3.4 导管血栓发生率 共纳入4项研究,各研究间无异质性(I2=0%,P=0.77),应用固定效应模型。Meta分析结果显示,治疗组与对照组导管血栓发生率相比,差异无统计学意义[RR=1.11,95%CI(0.68,1.83),P=0.68]。
2.3.5 全因死亡率 共纳入5项研究,各研究间无异质性(I2=0%,P=0.69),应用固定效应模型。Meta分析结果显示,治疗组与对照组全因死亡率相比,差异无统计学意义[RR=0.89,95%CI(0.36,2.22),P=0.80]。
3 讨 论
3.1 抗生素封管对预防CLABSI的有效性 本Meta分析的结果显示,使用抗生素封管可降低CLABSI的发生率及导管病原菌定植率,且不会增加导管出口部位感染发生率。从发病机制来说,CRBSI的发生是由于皮肤上的细菌移位,导致导管管腔内外形成生物被膜,从而引起病原微生物的定植和入血所造成的[25]。导管植入24~48 h后,纤维蛋白鞘将导管周围包绕,病原微生物大量繁殖,引起导管细菌定植[26],而抗生素封管技术则通过将高浓度的抗菌药物注入并保留在管腔内,使抗菌药物能够渗透到细菌生物膜的实质当中,起到直接有效的杀灭细菌,铲除生物膜的作用[27]。Costerton等[28]的一项基础研究也表明,含有抗微生物剂的溶液可以防止生物膜形成。因此,使用抗生素封管技术来预防CLABSI是有理论依据的。
3.2 抗生素封管的安全性 本研究结果显示,使用抗生素封管不会增加血栓发生率及全因死亡率,纳入分析的研究也均未提出抗生素封管组有耐药情况的发生。分析认为,细菌产生耐药的原理是由于其可以发生基因突变,突变后的细菌启动排外系统来阻挡抗菌药物的穿透,同时产生钝化酶(如β内酰胺酶),钝化酶与抗菌药物的β内酰胺环结合后该环被打开,致使药物失灵。而导管用药可以迅速杀灭细菌,切断了细菌产生耐药的路径,因此更不易产生耐药[27]。敖薪等[27]将内含细菌生物膜的导管植入随机分组后的3组动物血管中,其中全身组肌注头孢他啶,同时导管内注入无菌生理盐水+肝素混合液;导管组导管内注入头孢他啶+肝素混合液;联合组肌注头孢他啶的同时向导管内注入肝素+头孢他啶混合液,一段时间后,测定外周血标本的抑菌环直径及血管内皮细胞损伤标记物(vWF),结果显示3组动物血药敏试验抑菌环的直径均≥15 mm,其中以导管组直径最大;自置管第2 d起至拔管,3组动物外周血的vWF含量均有升高,且全身组升高水平显著高于其他两组(P<0.05),表明与全身使用抗菌药物比较,抗生素锁技术更不易产生耐药,血管内皮细胞损伤与中心静脉导管的留置和感染的程度有关,而与抗生素锁技术无关。由此可见,抗生素封管技术是相对安全的。
3.3 研究的局限性 本研究仅纳入了中、英文文献,可能存在语言偏倚。此外,受制于纳入研究的数量,在进行数据合并时无法针对不同抗生素种类、浓度及剂量进行亚组分析,可能会对本研究的论证强度有所影响。建议今后的研究可针对不同种类、不同浓度及剂量的抗生素的封管效果及安全性进行探讨。
4 结 论
本Meta研究结果表明,使用抗生素封管可降低CLABSI的发生率及导管病原菌定植率,且不会增加导管出口部位感染发生率、血栓发生率及全因死亡率,是一种有效且相对安全的封管方式。但是,鉴于纳入研究的数量及质量上的局限性,结果仍需更多高质量、大样本的RCT来进行验证。
[1]么莉.护理敏感质量指标实用手册(2016版) [M].北京:人民卫生出版社,2016.
[2]马坚.导管相关性血流感染的预防控制指南2011年版本[J].中华医院感染学杂志,2011,21(12):2648-2650.
[3]杨屹珺.中心静脉导管相关性感染危险因素及临床护理进展[J].中华护理杂志,2010,45(2):175-178.
[4]张慧,李夏卉,叶艳胜,等.乙醇封管对导管相关性血流感染预防效果的Meta分析[J].中华医院感染学杂志,2017,27(18):4159-4162,4194.
[5]MERMEL L A, ALLON M, BOUZA E, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 update by the infectious diseases society of America[J]. Clinical Infectious Diseases, 2009, 49(1): 1-45.
[6]O’GRADY N P, ALEXANDER M, BURNS L A, et al. Guidelines for the prevention of intravascular catheter-related infections[J]. Clin Infect Dis, 2011, 52(9): e162-e193.
[7]中华医学会重症医学分会.血管内导管相关感染的预防与治疗指南(2007)[J].中华外科杂志,2008,46(19):1441-1449.
[8] HIGGINS J P T, GREEN S. Cochrane handbook for systematic review of interventions version 5.1.0 [EB/OL]. https://www.cochrane-handbook.org.
[9]BETJES M G, VAN AGTEREN M. Prevention of dialysis catheter-related sepsis with a citrate-taurolidine-containing lock solution[J]. Nephrol Dial Transplant, 2004, 19(6): 1546-1551.
[10]CAMPOS R P, DO NASCIMENTO MM, CHULA D C, et al. Minocycline-EDTA lock solution prevents catheter-related bacteremia in hemodialysis[J]. J Am Soc Nephrol, 2011, 22(10): 1939-1945.
[11]CARRATAL J, NIUB
J, NIUB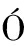 J, FERN
J, FERN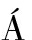 NDEZ-SEVILLA A, et al. Randomized, double-blind trial of an antibiotic-lock technique for prevention of gram-positive central venous catheter-related infection in neutropenic patients with cancer[J]. Antimicrob Agents Chemother, 1999, 43(9): 2200-2204.
NDEZ-SEVILLA A, et al. Randomized, double-blind trial of an antibiotic-lock technique for prevention of gram-positive central venous catheter-related infection in neutropenic patients with cancer[J]. Antimicrob Agents Chemother, 1999, 43(9): 2200-2204.
[12]BLEYER A J, MASON L, RUSSELL G, et al. A randomized, controlled trial of a new vascular catheter flush solution (minocycline-EDTA) in temporary hemodialysis access[J]. Infection Control and Hospital Epidemiology, 2005, 26(6): 520-524.
[13]FERREIRA CHACON J M, HATO DE ALMEIDA E, DE LOURDES SIM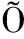 ES R, et al. Randomized study of minocycline and edetic acid as a locking solution for central line (Port-A-Cath) in children with cancer[J]. Chemotherapy, 2011, 57(4): 285-291.
ES R, et al. Randomized study of minocycline and edetic acid as a locking solution for central line (Port-A-Cath) in children with cancer[J]. Chemotherapy, 2011, 57(4): 285-291.
[14]FILIPPI L, PEZZATI M, DI AMARIO S, et al.Fusidic acid and heparin lock solution for the prevention of catheter-related bloodstream infections in critically ill neonates: a retrospective study and a prospective, randomized trial[J]. Pediatr Crit Care Med, 2007, 8(6): 556-562.
[15]GARLAND J S, ALEX C P, HENRICKSON K J, et al. A vancomycin-heparin lock solution for prevention of nosocomial bloodstream infection in critically ill neonates with peripherally inserted central venous catheters: a prospective, randomized trial[J]. Pediatrics, 2005, 116(2): e198-e205.
[16]HANDRUP MM, FUURSTED K, FUNCH P, et al. Biofilm formation in long-term central venous catheters in children with cancer: a randomized controlled open-labelled trial of taurolidine versus heparin[J]. APMIS, 2012, 120(10): 794-801.
[17]MCINTYRE C W, HULME L J, TAAL M, et al. Locking of tunneledhemodialysis catheters with gentamicin and heparin[J]. Kidney Int, 2004, 66(2): 801-805.
[18]MORAN J, SUN S, KHABABA I, et al. A randomized trial comparinggentamicin/citrate and heparin locks for central venous catheters in maintenance hemodialysis patients[J]. Am J Kidney Dis, 2012, 59(1): 102-107.
[19]MORTAZAVI M, ALSAEIDI S, SOBHANI R, et al. Successful prevention of tunneled, central catheter infection by antibiotic lock therapy usingcefotaxime[J]. J Res Med Sci, 2011, 16(3): 303-309.
[20]RACKOFF W R, WEIMAN M, JAKOBOWSKI D, et al. A randomized, controlled trial of the efficacy of a heparin and vancomycin solution in preventing central venous catheter infections in children[J]. J Pediatr, 1995, 127(1): 147-151.
[21]ZHANG P, YUAN J, TAN H Z, et al. Successful prevention of cuffed hemodialysis catheter-related infection using an antibiotic lock technique by strictly catheter-restricted antibiotic lock solution method[J]. Blood Purif, 2009, 27(2): 206-211.
[22]王晶,崔朝勃,魏秋菊,等.去甲万古霉素封管预防重症患者中心静脉导管相关性感染的临床研究[J].中国临床医生杂志,2016(10):39-41.
[23]王红,邓孝陵,李小杰,等.肝素与抗菌药物封管预防中心静脉导管感染的临床对比研究[J].中华医院感染学杂志,2015,25(7):1590-1592.
[24]汤颖,钟一红,丁小强,等.头孢唑林封管预防血液透析患者中心静脉导管相关感染的前瞻性研究[J].复旦学报:医学版,2009,36(5):523-527.
[25]王晶,崔朝勃,王金荣,等.去甲万古霉素封管预防重症患者中心静脉导管相关性感染的前瞻性随机对照研究[J].中华危重病急救医学,2014,26(7):468-472.
[26]陆蕾,吴蕾,刘琼.预防中心静脉导管相关性血流感染集束化护理的效果观察[J].中华医院感染学杂志,2014,24(22):5548-5550.
[27]敖薪,王娟.抗生素锁技术在治疗中心静脉导管相关性感染中的应用研究[J].中华医院感染学杂志,2016,26(23):5433-5435.
[28]COSTERTON J W, STEWART P S, GREENBERG E P. Bacterial biofilms: a common cause of persistent infections[J]. Science, 1999, 284(5418): 1318-1322.