呼吸道感染是儿童的常见多发病,多由细菌、真菌、病毒、支原体及衣原体等引起[1],但同一种病原体感染可有多种临床表现,同一临床表现又可由多种病原体导致[2],故临床很难针对特定的病原体进行治疗,延误患儿病情的同时也加剧了抗生素的滥用情况[2-3];呼吸道病原体的分布因地区、性别、气候、年龄等因素的不同存在差异[4-5],因此,运用九项呼吸道联检试剂联合检测患儿血清中IgM抗体,快速明确病原体,并掌握本地区儿童呼吸道病原体的流行趋势,对疾病的预防、诊断及治疗具有重要意义。本研究通过对我院6094例呼吸道感染患儿的九项呼吸道感染病原体IgM抗体进行检测,分析了病原体种类及年龄、性别和季节性等流行病学分布特征,现报道如下。
1 资料与方法
1.1 一般资料 收集2016年1—12月我院门诊及住院呼吸道感染患儿血清中九项呼吸道感染病原体IgM抗体的检测结果,共6094例,其中男童3687例,女童2407例,年龄为0~14岁。根据人民卫生出版社《儿科学》第8版的定义,将本研究中患儿按年龄分成4组:0~1岁组(3571例)、1~3岁组(1369例)、3~7岁组(818例)及7~14岁组(336例);儿童呼吸道感染的诊断标准见诸福棠主编的《实用儿科学》第8版,所入选患儿均无自身免疫性疾病等基础疾病,且未在外院治疗。
1.2 仪器与试剂 仪器选用日本奥林巴斯生产的EUROStar Ⅲ Plus荧光显微镜,试剂盒为西班牙VIRCELL S L生产的间接免疫荧光法(IFA)九项呼吸道感染病原体IgM抗体检测试剂盒。
1.3 检测方法 使用无添加剂的红色真空采血管采集患儿静脉血3 ml,并及时送检,于当日完成样本血清中嗜肺军团菌血清1型(LP1),肺炎支原体(MP),Q热立克次体(COX),肺炎衣原体(CPn),呼吸道合胞病毒(RSV),腺病毒(ADV),甲型流感病毒(INFA),乙型流感病毒(INFB),副流感病毒1、2、3型(PIVs)九项病原体的IgM 抗体检测。
1.4 结果判断 阳性结果:ADV,INFA,INFB,RSV和PIVS对阳性血清1%~15%细胞的细胞核、胞浆或胞膜出现苹果绿色荧光;LP1、CPn和COX中所有细菌呈苹果绿色荧光;MP对阳性血清在细胞外围呈苹果绿色荧光。阴性结果:LP1、CPn和COX无荧光,MP、ADV、INFA、INFB、RSV和PIVS的细胞呈红色。
1.5 统计学方法 采用Excel 2007进行数据统计,SPSS 19.0统计学软件进行数据分析。计数资料以百分数(%)表示,率的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同病原体的阳性率 6094例患儿血清标本共检出812例阳性患者,总阳性率为13.32%,各病原体阳性率由高到低依次为MP(570/9.35%)、PIVs(133/2.18%)、INFB(103/1.69%)、RSV(66/1.08%)、ADV(49/0.80%)、LP1(2/0.03%)、INFA(1/0.02%),而未检出COX和CPn阳性患者。
2.2 不同性别间阳性率的比较 812例阳性患者中,男童403例,女童409例,其阳性率分别为10.93%、16.99%,女童显著高于男童,差异有统计学意义(P<0.01);其中MP、PIVs及INFB阳性率女童显著高于男童(均P<0.05),RSV阳性率男童显著高于女童(P<0.05),而ADV、LP1和INFA阳性率性别差异无统计学意义(均P>0.05)。
2.3 病原体混合感染情况分析 812例阳性患儿中,共发现混合感染者108例(13.30%),阳性患者混合感染中男童45例(11.17%),女童63例(15.40%),其混合阳性率性别差异无统计学意义(P=0.125)。104例为2种病原体的混合感染,4例为3种病原体的混合感染;混合感染以MP+INFB最常见,其次为MP+PIVs和MP+ADV;1月份混合感染数最多。
2.4 不同月份病原体的感染情况 MP全年均流行,以9月的阳性率最高,除与8月的PIVs、12月的RSV阳性率比较无统计学意义外,均显著高于其他病原体阳性率;ADV每月的阳性率均较低,以7月份最高;PIVs每月均有检出,但主要流行于8~11月,以10月份的阳性率最高,3~4月的阳性率最低;RSV和INFB分别在1~7月、9~12月均未检出,其中RSV以12月份的阳性率最高,INFB则1月份的阳性率最高。见表1。
表1 不同月份呼吸道病原体IgM 抗体检测阳性结果 [例(%)]
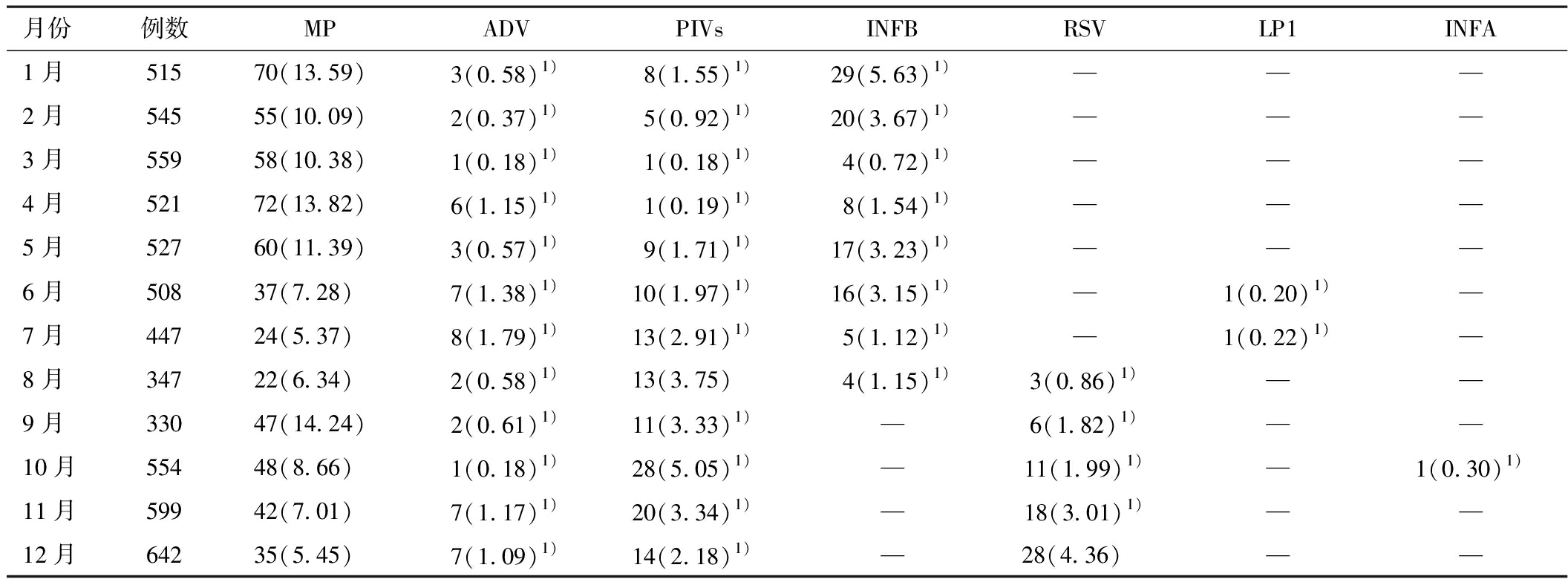
月份例数 MPADVPIVsINFBRSVLP1INFA1月51570(13.59)3(0.58)1)8(1.55)1)29(5.63)1)———2月54555(10.09)2(0.37)1)5(0.92)1)20(3.67)1)———3月55958(10.38)1(0.18)1)1(0.18)1)4(0.72)1)———4月52172(13.82)6(1.15)1)1(0.19)1)8(1.54)1)———5月52760(11.39)3(0.57)1)9(1.71)1)17(3.23)1)———6月50837(7.28)7(1.38)1)10(1.97)1)16(3.15)1)—1(0.20)1)—7月44724(5.37)8(1.79)1)13(2.91)1)5(1.12)1)—1(0.22)1)—8月34722(6.34)2(0.58)1)13(3.75)4(1.15)1)3(0.86)1)——9月33047(14.24)2(0.61)1)11(3.33)1)—6(1.82)1)——10月55448(8.66)1(0.18)1)28(5.05)1)—11(1.99)1)—1(0.30)1)11月59942(7.01)7(1.17)1)20(3.34)1)—18(3.01)1)——12月64235(5.45)7(1.09)1)14(2.18)1)—28(4.36) ——
注:1)与MP当月阳性率比较P<0.05
2.4 不同年龄段病原体阳性率分析 6094例患儿按不同年龄段分组后,阳性率由高到低依次为1~3岁组(290/21.18%)、3~7岁组(164/20.05%)、7~14岁组(61/18.15%)、0~1岁组(297/8.32%)。1~3岁组、3~7岁组及7~14岁组3组间差异无统计学意义(P>0.05),但均显著高于0~1岁组(P<0.01)。
2.5 不同年龄段、不同性别间病原体阳性率分析 将患儿按不同年龄段分组后,1~3岁组、3~7岁组、7~14岁组阳性率女童均显著高于男童(P<0.05或P<0.01),仅0~1岁组性别差异无统计学意义(P>0.05)。见表2。
表2 不同年龄段、不同性别间病原体阳性率的比较分析
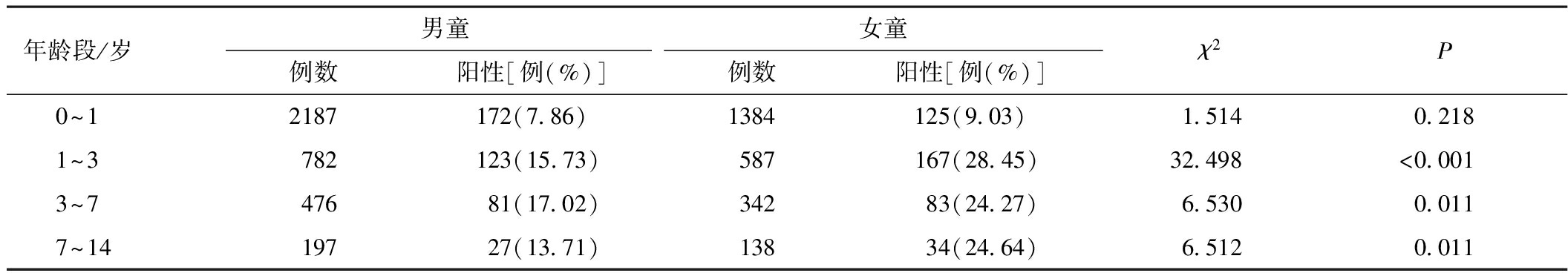
年龄段/岁男童女童例数阳性[例(%)]例数阳性[例(%)]χ2P0~12187172(7.86)1384125(9.03)1.5140.2181~3782123(15.73)587167(28.45)32.498<0.0013~747681(17.02)34283(24.27)6.5300.0117~1419727(13.71)13834(24.64)6.5120.011
3 讨 论
儿童由于具有气道狭小、软骨柔软、黏膜血管丰富、纤毛运动功能差、肺泡数量少且面积小、呼吸储备能力差等生理解剖特点[4],且自身免疫系统发育不完善,抵抗力较成人弱,呼吸道易受到病原菌的侵袭而引发感染,其发病率已占儿童疾病发生率的首位[1],感染多由细菌以外的非典型病原体引起[2-3]。本研究结果显示,遂宁地区儿童呼吸道感染时九项呼吸道病原体检出阳性率为13.32%,明显低于相关文献的报道[2-5];其中MP感染的检出率最高,与相关文献报道一致[3-5];其次为PIVs、INFB、RSV、ADV、LP1及INFA,而未检出COX和CPn。这说明本地区儿童呼吸道病原体以MP和PIVs为主,这与湖北十堰地区相同[1],而河南新乡地区[5] 及苏州地区[6]儿童呼吸道病原体为MP和LP1为主,西安地区[2]、广州番禺区[4]及合肥地区[7]则以MP和INFB为主,这可能与当地气候环境、诊断标准及研究对象不同等因素有关。本地区阳性患儿中混合感染占13.30%,无性别差异,以MP合并INFB的二重感染最常见,其次为MP+PIVs和MP+ADV,并多见于1月和10月,故患儿单一用药疗效不理想时,应考虑混合感染,避免抗生素的滥用[7-8]。
不同年龄及性别组对呼吸道病原体的易感性存在差异,本研究结果显示,女童总体感染阳性率显著高于男童,与文献报道一致[5,7]。本研究将患儿按不同年龄段分组后发现,随着年龄的增长,患儿发生呼吸道感染的病例数也逐渐减少,这可能与机体自身免疫系统逐渐发育成熟有关。但呼吸道病原体的阳性率以0~3岁组最高(21.18%)、0~1岁组最低(8.32%),这可能的原因是0~3岁组与3~7岁组及7~14岁组相比,儿童免疫力相对低下而又未形成良好的生活习惯,从而导致其阳性率最高;而0~1岁组大部分处于母乳喂养阶段,通过母乳中含有的分泌型IgA获得了一定的抵抗力,同时因不能独立行走并有专人照顾,其个人卫生情况较好,且与其他组相比不常处于一个人口密集的环境,发生交叉感染和局部爆发流行的机会较少,故其阳性率最低。
儿童呼吸道病原体的流行具有明显的季节性[1],从本研究可发现,本地区MP全年均流行,以9月的阳性率最高, ADV每月的阳性率均较低,以7月份最高;PIVs每月均有检出,以10月份的阳性率最高;RSV和INFB分别在1~7月、9~12月均未检出,其中RSV以12月份的阳性率最高,INFB则1月份的阳性率最高;LP1仅在6月及7月分别检出1例,INFA仅在10月检出1例,低于相关文献报道的结果[1-2],而高于李涛等[7]报道的结果,可能与不同地区不同月份的温度、湿度、光照和降雨量等气候因素有关。COX和CPn全年均未检出,与解娟等[2] 、李涛等[7]的报道一致。有文献报道,部分病原体具有隔年高峰现象[6]。笔者仅对2016年的流行特点进行了讨论,需进一步分析。
综上所述,患儿呼吸道感染时病原体的分布受当地气候环境、性别和年龄等因素的影响,运用九项呼吸道感染病原体IgM抗体检测试剂联合检测患儿血清中IgM抗体,可快速明确呼吸道感染的病原体,同时定期对本院呼吸道感染患儿的病原检测结果进行分析,可掌握本地区儿童呼吸道病原体的流行病学特征。但机体感染病原体后需要一定的时间才能产生特异性IgM 抗体,故临床上要密切结合患儿的性别、年龄、病史、免疫状态及其他项目的检测结果[9-10,7],去正确分析和判断,条件允许时应尽可能采集患儿恢复期或是感染后期的血清做对照分析,这样病原学诊断意义更大。
[1]左万超,瞿新,梁荣鑫,等.九项呼吸道病原体联合检测在儿科呼吸道疾病诊断中的应用[J].检验医学与临床,2017,14(1):60-62.
[2]解娟,张梦瑶,李小侠,等.九项呼吸道病原体IgM抗体联合检测对儿童呼吸道感染的临床意义[J].现代检验医学杂志,2016,31(4):110-112, 116.
[3]杨永弘,马香.小儿呼吸道感染的细菌病原[J].实用儿科临床杂志,2011,26(4):229-232.
[4]黄瑞娟,江健升,陈炜业.广州市番禺区儿童社区获得性肺炎的病原体分析[J].中国医师杂志,2015,17(7):1064-1067.
[5]葛廷,赵洁,韩玉芳,等.1482例呼吸道感染患者病原体检测结果分析[J].中国实用医刊,2017,44(8):5-7.
[6]季伟,陈正荣,郭红波,等.苏州儿童医院住院儿童呼吸道病毒的流行特点及与气候因素的相关性研究[J].中华预防医学杂志,2011,45(3):205-210.
[7]李涛,徐恩君,陈秋莉,等.呼吸道感染儿童九项呼吸道病原体 IgM 抗体结果分析[J].安徽医科大学学报,2016,51(7):1011-1014.
[8] WATANABE H, URUMA T, NAKAMURA H, et al. The role of Mycoplasma pneumoniae infection in the initial onset and exacerbations of asthma[J]. Allergy Asthma Proc, 2014, 35(3): 204-210.
[9]刘宏景,窦敏,陈惠,等.儿童非典型呼吸道病原体感染与血清IgE水平的相关性研究[J].国际检验医学杂志,2015,36(17):2480-2481,2484.
[10]林应荣,江金彪,罗玲玲,等.应用CRP和PCT检测对儿童下呼吸道感染早期诊断的价值[J].中国医药导报,2014,11(8):88-90.