心衰为各种心脏疾病的严重和终末阶段,是当今重要的心血管病之一,具有发病率高、住院率高、死亡率高的特点。在以往对心衰的研究中,将心衰分为射血分数降低的心衰或收缩性心衰及射血分数保留的心衰或舒张性心衰。目前对于心衰的治疗策略和方法使射血分数降低的心衰的住院率和病死率有了明显的下降,但对射血分数保留的心衰仍是阴性结果。2016 ESC指南对心衰提出了射血分数中间值的心衰,认为它是射血分数降低心衰和射血分数保留心衰之间的一个灰区,患者很可能主要为轻度收缩功能不全,但有舒张功能不全的特点[1]。D-二聚体、胱抑素C、β2微球蛋白、B型钠尿肽(BNP)、血尿酸、肌钙蛋白Ⅰ(cTnI)均与心血管疾病的发生发展有着密切相关[2-6],而心衰作为一个长期发展的过程在病理生理及生化代谢方面也会有一些特征性的表现和变化。本研究收集不同分类心衰患者的一些相对较为重要的指标进行分析,旨在探讨不同分类心衰的病理生理特征和发病机制。
1 资料与方法
1.1 一般资料 选取2016年8月至2017年6月在我院心血管内科住院治疗的心衰病人共56例作为研究对象。其中男性30例,女性26例,平均年龄(74.47±9.98)岁。所有患者诊断均符合《中国心力衰竭诊断和治疗指南2014》中的诊断标准。排除合并慢性阻塞性肺部疾病的慢性心力衰竭患者、慢性心力衰竭伴有重度二尖瓣反流及急性心肌梗死患者。记录患者的一般情况、实验室检验数据、超声心动图检查结果。
1.2 分组与治疗 根据心脏彩超检查所得左室射血分数(LVEF)将56例患者分为3组:射血分数保留心衰组(HFpEF组,EF≥50%)18例、射血分数中间值心衰组(HFmrEF组,EF<40%~50%)15例、射血分数降低心衰组(HFrEF组,EF<40%)23例。收集56例患者的基础病、合并症等一般资料,以及入院24 h内的实验室检测指标,包括3大常规检查、BNP、cTnI、血肌酐、血尿酸、D-二聚体、血清胱抑素C、血β2微球蛋白等,行超声心动图检查,并根据病情需要复查。所有患者均根据指南推荐给以利尿、扩血管、ACEI、β受体阻滞剂以及控制并发症等综合治疗。
1.3 统计学方法 采用SPSS 22.0软件对数据进行统计学分析。计量资料以均数±标准差表示,符合正态分布的数据多组间比较采用单因素方差分析;相关性采用双变量直线相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料比较 HFrEF组中男性比例明显大于女性,其余2组男女比例接近。3组间年龄比较无显著性差异(F=2.912,P=0.063),EF值比较有显著性差异(F=282.572,P=0.000),表明3组患者左室射血分数明显不同。见表1。
表1 3组一般资料比较![]()
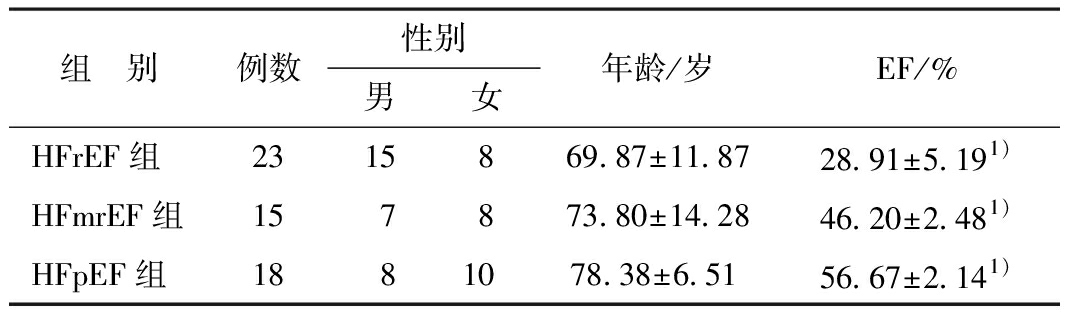
组 别例数性别男女年龄/岁EF/%HFrEF组2315869.87±11.8728.91±5.191)HFmrEF组157873.80±14.2846.20±2.481)HFpEF组1881078.38±6.5156.67±2.141)
注:1)3组间比较P<0.05
2.2 临床理化指标比较 3组的BNP、LVEDD、血尿酸之间存在显著性差异(均P<0.05),血β2微球蛋白、血胱抑素C、血肌酐、D-二聚体、cTnI之间无显著性差异(均P>0.05),见表2。相关性分析显示EF值与BNP(r=-0.56,P=0.000)、LVEDD(r=-0.713,P=0.000)、血尿酸(r=-0.426,P=0.001)呈负相关(均P<0.05),EF值与其他指标无显著性相关(均P>0.05)。
表2 3组理化指标的比较![]()
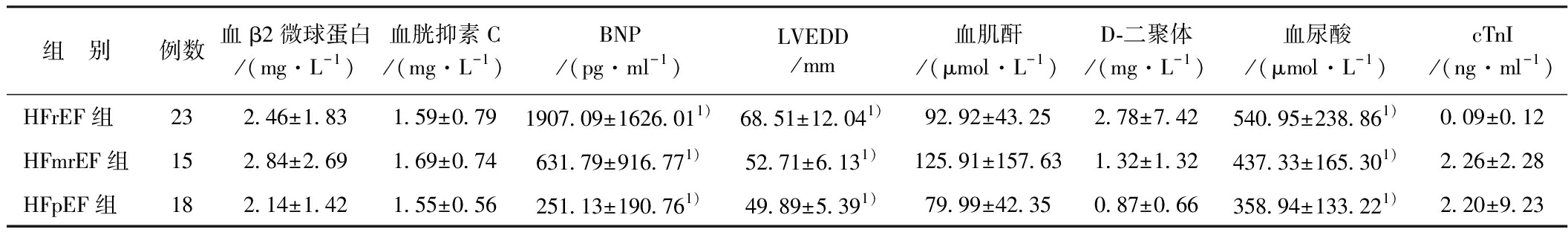
组 别例数血β2微球蛋白/(mg·L-1)血胱抑素C/(mg·L-1)BNP/(pg·ml-1)LVEDD/mm血肌酐/(μmol·L-1)D-二聚体/(mg·L-1)血尿酸/(μmol·L-1)cTnI/(ng·ml-1)HFrEF组232.46±1.831.59±0.791907.09±1626.011)68.51±12.041)92.92±43.252.78±7.42540.95±238.861)0.09±0.12HFmrEF组152.84±2.691.69±0.74631.79±916.771)52.71±6.131)125.91±157.631.32±1.32437.33±165.301)2.26±2.28HFpEF组182.14±1.421.55±0.56251.13±190.761)49.89±5.391)79.99±42.350.87±0.66358.94±133.221)2.20±9.23
注:1)3组间比较P<0.05
3 讨 论
本研究结果显示3组患者的EF值存在显著性差异,表明3组患者心功能有差异,新的分类方法对于进一步认识心衰本质有着重要意义。在各项指标的比较分析中,仅BNP、LVEDD、血尿酸3项在组间存在统计学差异,心衰患者BNP升高,BNP的高低程度也可以预测心衰的严重程度和预后。相关性分析中,BNP与EF值呈显著性负相关,提示3种不同分型心衰在严重程度上有根本不同,临床上可结合BNP的高低对心衰进行分类,从而进一步指导治疗和判断预后。血尿酸升高是心血管疾病的危险因素[6-8],本研究中3组间血尿酸水平具显著性差异,相关性分析与EF值呈负相关,说明血尿酸水平高低与心衰严重程度相关,血尿酸高低可以作为心衰分类的参考和依据。降低血尿酸水平除可降低心血管疾病发病的风险外,也可能是治疗心衰的一个靶点。LVEDD在排除了二尖瓣大量反流、心脏分流等因素后,本身与EF值为负性相关的关系,本研究中LVEDD与EF值呈负相关,说明本研究中选取对象较为严谨,干扰因素少。在组间比较中LVEDD也有统计学差异,说明LVEDD与EF值一样,可以作为心衰分类的依据和参照,从而更好地指导心衰的诊断和治疗。
胱抑素C和β2微球蛋白可以反映高血压、糖尿病等引起的早期肾损害,血肌酐高低是反映肾功能的经典指标[9-10]。本研究中无论组间比较还是相关性分析,这3项指标差异均无统计学意义。可能提示不同类型心衰或心衰的严重程度可能独立于肾功能损害的程度,肾功能损害的严重程度并不能反映心功能降低的程度。一些研究表明心衰患者血液呈高凝状态[11],D-二聚体等凝血因子水平升高,本研究中D-二聚体水平随心衰的加重逐渐升高,但在3组间并无统计学差异,因此D-二聚体可以反映心衰的严重程度,但不能作为心衰分类的参照指标。cTnI在慢性心衰时常轻度升高,本研究中组间比较和相关性分析cTnI均无统计学意义,提示心衰时cTnI升高可能与心肌缺血等原发病有关,而不是心衰本身独有的病理过程导致。
本研究结果提示,BNP、血尿酸、LVEDD均与心衰分类相关,可考虑作为未来心衰分类和诊断可能的依据,从而更好地认识心衰的本质,指导心衰的治疗。本研究中分组较多,各组纳入病例数相对较少,可能会影响最终的结论,是本研究的不足,但至少提供了今后在更大规模的病例基础上进一步研究的线索,为更好地诊治心衰提供了一种思路。
[1]PONIKOWSKI P, VOORS A A, ANKER S D, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. Kardiol Pol, 2016, 74(10): 1037-1147.
[2] FOSTER M C, CORESH J, HSU C Y, et al. Serum β-trace protein and β2-microglobulin as predictors of ESRD, mortality, and cardiovascular disease in adults with CKD in the Chronic Renal Insufficiency Cohort (CRIC) Study[J]. American Journal of Kidney Diseases, 2016, 68(1): 68-76.
[3]ZAMORA E, LUP N J, URRUTIA A, et al. Estimated creatinine clearance: a determinant prognostic factor in heart failure[J]. Med Clin (Barc), 2008, 131(2): 47-51.
N J, URRUTIA A, et al. Estimated creatinine clearance: a determinant prognostic factor in heart failure[J]. Med Clin (Barc), 2008, 131(2): 47-51.
[4]HASHIMOTO T, ISHII J, OKUYAMA R, et al. Prognostic value of plasma concentration of D-dimer on admission for in-hospital mortality in patients hospitalized for worsening heart failure[J]. J Card Fail, 2012, 18(10): S178-S179.
[5]ZHANG Y, LI Y, CHENG G. Effect of low-dose diuretics on the level of serum cystatin C and prognosis in patients with asymptomatic chronic heart failure[J]. Exp Ther Med, 2015,10(6): 2345-2350.
[6]LI Z J, YI C J, LI J, et al. Serum uric acid level as a cardio-cerebrovascular event risk factor in middle-aged and non-obese Chinese men[J]. Oncotarget, 2017, 8(15): 24110-24118.
[7]KHAN A, SHAH M H, KHAN S, et al. Serum uric acid level in the severity of congestive heart failure (CHF)[J]. Pak J Med Sci, 2017, 33(2): 330-334.
[8]HUANG H, HUANG B T, LI Y L, et al. Uric acid and risk of heart failure: a systematic review and meta-analysis[J]. Eur J Heart Fail, 2014, 16(1): 15-24.
[9] MOJIMINIYI O A, ABDELLA N. Evaluation of cystatin C and β-2 microglobulin as markers of renal function in patients with type 2 diabetes mellitus[J]. Journal of Diabetes and its Complications, 2003, 17(3): 160-168.
[10]XIE L F, TERRAND J, XU B B, et al. Cystatin C increases in cardiac injury: a role in extracellular matrix protein modulation[J]. Cardiovasc Res, 2010, 87(4): 628-635.
[11]ZORLU A, YILMAZ M B, YUCEL H, et al. Increased D-dimer levels predict cardiovascular mortality in patients with systolic heart failure[J]. J Thromb Thrombolysis, 2012, 33(4): 322-328.