近年来,随着冠心病(coronary heart disease,CHD)发病率逐渐升高以及经皮冠状动脉介入手术(percutaneous coronary intervention,PCI)适应证的不断扩展,含碘造影剂的使用日益广泛,造影剂急性肾损伤(contrast-induced acute kidney injury,CIAKI)的发病率亦不断増加,造影剂已成为继院内手术、低血压之后引起急性肾损伤(acute kidney injury,AKI)的第3大病因[1]。目前AKI的诊断标准,仍是以尿量和血肌酐(sCr)等传统指标作为依据,但是二者影响因素众多,不能准确、及时反映肾功能损伤情况,不能为临床早期诊断AKI提供足够的决策信息[2]。本研究以接受PCI术的CHD患者为研究对象,探讨中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)和半胱氨酸蛋白酶抑制剂C(Cys C)在PCI术后CIAKI中的诊断价值。
1 对象与方法
1.1 研究对象 本研究纳入2016年1月至2017年6月在绵阳市中心医院心内科病房(含CCU病区)诊断为CHD的住院患者,所有患者冠状动脉造影(coronary angiography,CAG)后均行PCI术。纳入标准为:(1)所有患者均为CHD,包括急性冠状动脉综合征及稳定型心绞痛;(2)PCI包括急诊手术及择期手术;(3)术前、术后12~48 h均有检测sCr、NGAL和Cys C等;(4)患者术后24 h内均采用了水化治疗[(l~1.5) ml/(kg·h)];(5)术前均使用他汀类治疗药物。排除标准:(1)造影剂过敏患者;(2)严重心功能不全患者;(3)既往有动脉造影或冠状动脉介入治疗病史患者;(4)有基础肾损伤疾病及正在实施血液透析治疗的患者。
本研究CIAKI的诊断标准采用改善全球肾脏病预后组织(KDIGO)于2012年发布的《KDIGO急性肾损伤临床实践指南》中关于AKI的诊断标准,即:48 h内sCr水平升高≥26.5 μmol/L或超过基础值的1.5倍及以上,且明确或经推断上述情况发生在7 d之内;或持续6 h尿量<0.5 ml/(kg·h)。
本研究最终纳入435例患者,根据术后48 h是否发生AKI分为两组,即CIAKI组(21例)和Non-AKI组(414例)。
1.2 研究方法
1.2.1 一般临床资料收集 所有患者入院后即记录一般临床资料,包括人口统计学信息、心血管病史等。
1.2.2 临床生化指标检测 所有患者PCI术前,术后12 h、24 h、48 h,抽取3 ml静脉血,采用LST008型全自动生化分析仪(日本,HITACHI)测定血清生化指标,包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素、血糖、sCr、NGAL、Cys C等。
1.3 统计学方法 采用SPSS 19.0软件进行统计学分析。对CIAKI 的诊断敏感性和特异性采用ROC曲线来评价,以约登指数最大的标准选择截断值。计数资料以n或n(%)表示,多组间采用列联表χ2检验,两两比较采用连续校正χ2检验;计量资料采用单样本Kolmogorov-Smirnov分析方法进行正态性检验,以![]() 表示,多组间比较采用Kruskal-Wallis检验(非正态分布资料)或单因素方差分析(正态分布资料),两两比较采用Kruskal-Wallis检验之平均秩多重比较(非正态分布资料)或方差分析之LSD检验(正态分布资料)。以P<0.05为差异有统计学意义。
表示,多组间比较采用Kruskal-Wallis检验(非正态分布资料)或单因素方差分析(正态分布资料),两两比较采用Kruskal-Wallis检验之平均秩多重比较(非正态分布资料)或方差分析之LSD检验(正态分布资料)。以P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象术前基线资料 本研究最终纳入435例患者,按照CIAKI的诊断标准,共有21例患者发生CIAKI,发生率为4.8%。将研究对象分成CIAKI和Non-AKI组,两组性别、高血压构成比差异无统计学意义(P>0.05),而CIAKI组年龄较Non-AKI组高(P<0.05);CIAKI组肾功能状况较Non-AKI组差,表现为CIAKI组基线eGFR值更低,尿素值更高(P<0.05);CIAKI组冠状动脉病变数量更多,造影剂使用量更大(P<0.05)。见表1。
表1 研究对象术前基线资料比较
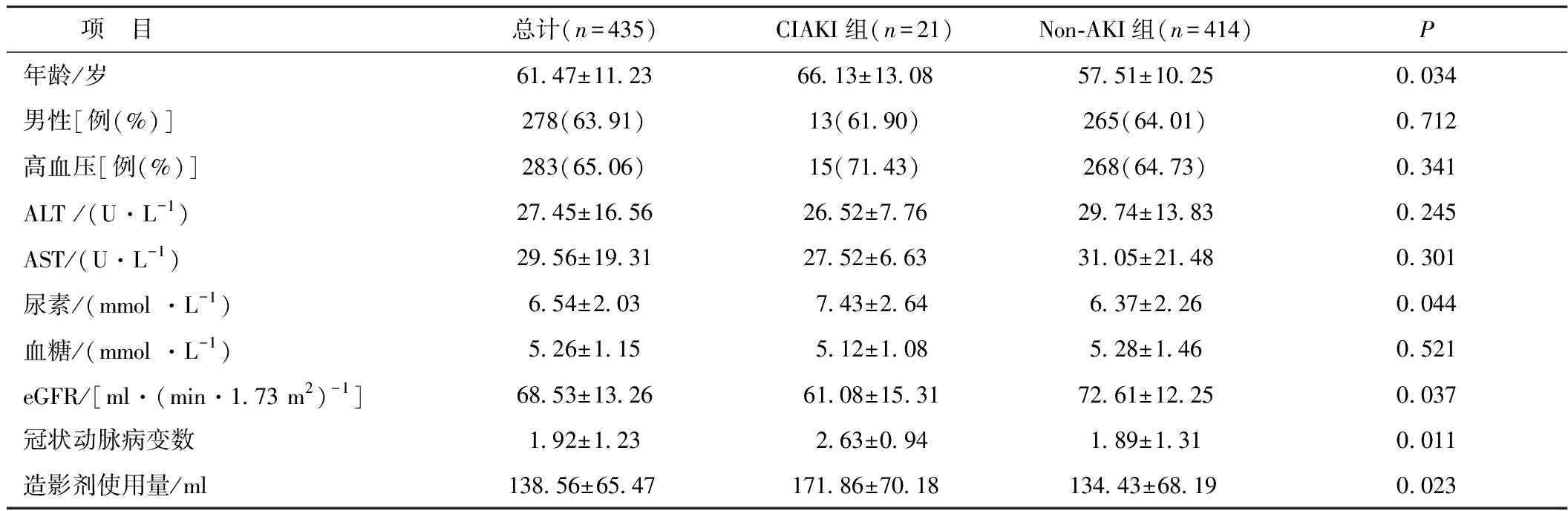
项 目总计(n=435)CIAKI组(n=21)Non-AKI组(n=414)P年龄/岁61.47±11.2366.13±13.0857.51±10.250.034男性[例(%)]278(63.91)13(61.90)265(64.01)0.712高血压[例(%)]283(65.06)15(71.43)268(64.73)0.341ALT /(U·L-1)27.45±16.5626.52±7.7629.74±13.830.245AST/(U·L-1)29.56±19.3127.52±6.6331.05±21.480.301尿素/(mmol ·L-1)6.54±2.037.43±2.646.37±2.260.044血糖/(mmol ·L-1)5.26±1.155.12±1.085.28±1.460.521eGFR/[ml·(min·1.73 m2)-1]68.53±13.2661.08±15.3172.61±12.250.037冠状动脉病变数1.92±1.232.63±0.941.89±1.310.011造影剂使用量/ml138.56±65.47171.86±70.18134.43±68.190.023
2.2 术前和术后不同时间点sCr、NGAL和Cys C含量分析 CIAKI组sCr、NGAL和Cys C术前水平均高于Non-AKI组术前水平,但仅NGAL水平有显著性差异(P<0.05); CIAKI组术后sCr、NGAL和Cys C水平呈现递增趋势,与术前比较, sCr水平在术后24 h、48 h,NGAL和Cys C水平在术后12 h、24 h、48 h有显著性差异(P<0.05);Non-AKI组术后sCr、NGAL和Cys C水平与术前比较均无显著性差异(P>0.05)。见表2。
表2 术后不同时间点sCr、NGAL和Cys C较术前比较

分 组观察指标PCT术前术后12 h术后24 h术后48 hCIAKI组sCr89.26±46.1891.12±63.25 136.09±56.541,2) 198.36±127.731,2)NGAL135.54±52.431)187.63±85.271,2)260.82±89.051,2) 352.14±114.281,2)Cys C0.72±0.181.13±0.261,2)1.67±0.231,2) 1.86±0.471,2)Non-AKI组sCr79.55±37.9278.64±42.09 84.71±38.98 86.28±47.26NGAL101.34±46.67 126.08±62.15 117.34±36.74 109.12±38.97 Cys C0.69±0.150.84±0.21 0.78±0.17 0.87±0.22
注:1)与术前比较P<0.05;2)与同时间点Non-AKI组比较P<0.05
2.3 CIAKI组术后早期NGAL、Cys C单独及联合诊断效能 术后12 h:选取NGAL值为191.37 ng/ml,敏感性及特异性分别为78.3%及73.9%,曲线下面积(AUC)为0.762;选取Cys C 值为1.24 ng/ml,敏感性及特异性分别为71.5%及75.4%,AUC 值为0.713;NGAL联合sCys C后,预测AKI的AUC可提高到0.834,敏感性及特异性分别为87.3%及85.6%,显著高于NGAL和Cys C单独诊断AKI的AUC,差异有统计学意义(P<0.05);
术后24 h:选取NGAL 值为256.63 ng/ml,敏感性及特异性分别为82.1% 及83.6%,AUC 值为0.775;选取Cys C 值为1.51 ng/ml,敏感性及特异性分别为83.9%及84.7%,AUC 值为0.786,差异有统计学意义(P<0.05);NGAL联合sCys C后,预测AKI的AUC可提高到0.843,敏感性及特异性分别为88.3%及87.4%,也高于NGAL和Cys C单独诊断AKI的AUC,但差异无统计学意义(P>0.05),见表3。
表3 术后早期NGAL和Cys C单独及联合诊断CIAKI的效能
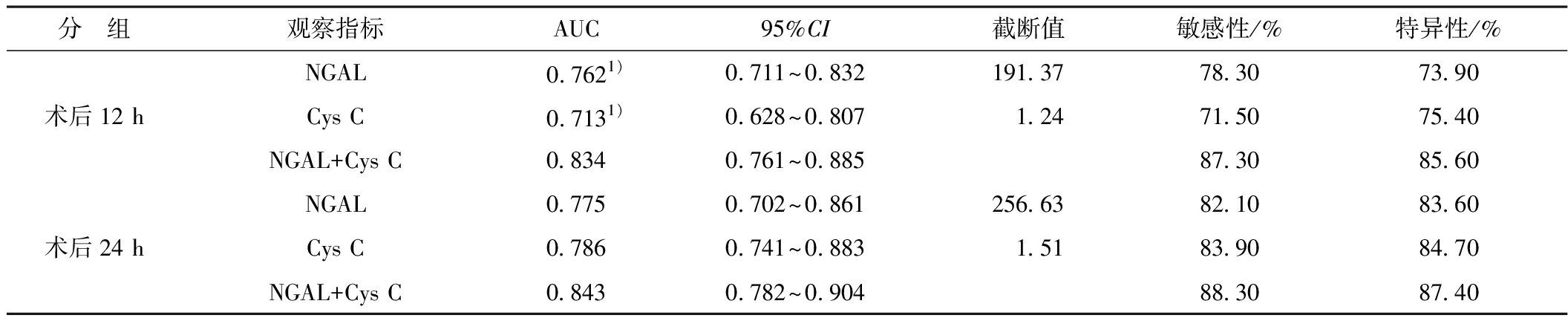
分 组观察指标AUC95%CI截断值敏感性/%特异性/%术后12 hNGAL0.7621)0.711~0.832191.3778.3073.90Cys C0.7131)0.628~0.8071.2471.5075.40NGAL+Cys C0.8340.761~0.88587.3085.60术后24 hNGAL0.7750.702~0.861256.6382.1083.60Cys C0.7860.741~0.8831.5183.9084.70NGAL+Cys C0.8430.782~0.90488.3087.40
注:1)与NGAL+Cys C比较P<0.05
3 讨 论
含碘造影剂是目前介入手术不可或缺的物质,近年来,随着冠状动脉造影的逐渐增加,以及PCI术适应证的不断扩展,造影剂相关的AKI发病率亦不断增加,造影剂已成为继手术、低血压之后引起院内AKI的第3位病因。CIAKI已成为冠状动脉介入治疗后的主要并发症之一[3]。对本研究患者术前基线资料分析发现,年龄、术前肾功能状况、冠状动脉病变数量和造影剂用量是CIAKI发生最重要的危险因素。
按照KDIGO对AKI新的诊断标准[4],目前其诊断主要还是基于sCr的变化,但sCr并不能及时准确地反映肾功能损伤[5],首先许多肾外因素(如年龄、种族、体质量、肌肉分解代谢等)均可影响sCr水平的高低;其次Cr在血液中的积聚需要一定时间,在急性肾功能损伤的演变过程中,只有在肾脏功能丧失50%以上,sCr才能发生显著变化,故sCr水平的变化往往滞后于肾功能的改变。现有多项临床研究均已证实NGAL和Cys C对AKI具有早期诊断价值[6-7]。NGAL是脂质运载蛋白家族的新成员,是从中性粒细胞中分离到的一种与明胶酶共价结合的蛋白,是急性缺血/再灌注术引起的肾脏损伤的敏感标志物[8-9];Cys C是半脱氨酸蛋白酶抑制剂超家族中的一员,由体内有核细胞产生并以相对恒定的速率释放入血,能精确反映肾小球滤过功能[10-11]。本研究证实血清NGAL和Cys C水平的升高对于CIAKI的发生具有可靠的预测价值,通过比较CIAKI和Non-AKI两组患者之间不同时间点NGAL和Cys C的血清水平,发现CIAKI组术后NGAL和Cys C水平呈现递增趋势,与术前比较,NGAL和Cys C在术后12 h即可增至有统计学差异,而sCr在术后24 h才增至有统计学差异,这说明CIAKI发生的24 h内,NGAL和Cys C水平的升高要比sCr升高更早,NGAL和Cys C对于AKI的早期诊断价值优于sCr,提示术后连续监测血NGAL和Cys C水平变化,可以早期诊断AKI,有利于临床及时采取相关治疗措施。
AKI生物标志物的开发和验证研究一直是肾脏疾病研究领域的热点和焦点,急性血透质量倡议小组(ADQI)推荐:联合两种或以上的生物标志物可以提高AKI的预测效能和准确性[12]。本研究选择NGAL和Cys C进行组合,研究结果显示,PCI术后12 h,NGAL和Cys C联合诊断CIAKI的AUC高于单独诊断CIAKI的AUC,差异有统计学意义(P<0.05);PCI术后24 h, 两者联合诊断CIAKI的AUC也高于单独诊断CIAKI的AUC,但差异无统计学意义(P>0.05);提示在PCI术后,联合监测血NGAL和Cys C水平变化,可以在提高AKI早期诊断的敏感性及特异性,进一步证实多个标志物组合诊断AKI的效能优于单个标志物,也进一步验证了ADQI关于采用组合标志物提高预测AKI效能的推荐意见。
综上所述, PCI术后NGAL和Cys C联合监测可更敏感地反映肾功能损伤,有利于早期准确识别造影剂引起的AKI。但是本研究时间终止点为术后48 h,只是对术后48 h内各指标的水平变化进行比较,从而判断NGAL和Cys C及传统指标sCr在CIAKI早期诊断中的价值,并没有追踪观测术后48 h以后各指标水平的变化,对二者在CIAKI恢复中的诊断价值尚需进一步研究。
[1]REAR R, BELL R M, HAUSENLOY D J. Contrast-induced nephropathy following angiography and cardiac interventions[J]. Heart, 2016, 102(8): 638-648.
[2]SONI S S, POPHALE R, RONCO C. New biomarkers for acute renal injury[J]. Clinical Chemistry and Laboratory Medicine, 2011, 49(8): 1257-1263.
[3]KOCAS B, ABACI O, CETINKAL G, et al. Contrast-induced acute kidney injury in patients with non-ST-segment elevation myocardial infarction undergoing early versus delayed invasive strategy[J]. Int J Cardiol, 2016, 203: 638-639.
[4]KELLUM J A,NOBERT L,ASPELIN P, et al. Kidney disease: improving global outcomes(KDIGO) acute kidney injury work group. KDIGO clinical practice guideline for acute kidney injury[J]. Kindey Int Suppl, 2012,2(1):1-138.
[5]KASHANI K, KELLUM J A. Novel biomarkers indicating repair or progression after acute kidney injury[J]. Curr Opin Nephrol Hypertens, 2015, 24(1): 21-27.
[6]PARMAKSIZ G, NOYAN A, DURSUN H, et al. Role of new biomarkers for predicting renal scarring in vesicoureteral reflux: NGAL, KIM-1, and L-FABP[J]. Pediatr Nephrol, 2016, 31(1): 97-103.
[7]PURDE M T, NOCK S, RISCH L, et al. Ratio of cystatin C and creatinine-based estimates of the glomerular filtration rate predicts mortality in healthy seniors Independent of kidney function[J]. Scand J Clin Lab Invest, 2016, 76(4): 341-343.
[8]FILIOPOULOS V, BIBLAKI D, VLASSOPOULOS D. Neutrophil gelatinase-associated lipocalin (NGAL): a promising biomarker of contrast-induced nephropathy after computed tomography[J]. Ren Fail, 2014, 36(6): 979-986.
[9]OBERMÜLLER N, GEIGER H, WEIPERT C, et al. Current developments in early diagnosis of acute kidney injury[J]. Int Urol Nephrol, 2014, 46(1): 1-7.
[10]SNIPS YR M G, LUDVIGSEN M, PETERSEN E, et al. A systematic review of biomarkers in the diagnosis of infective endocarditis[J]. Int J Cardiol, 2016, 202: 564-570.
YR M G, LUDVIGSEN M, PETERSEN E, et al. A systematic review of biomarkers in the diagnosis of infective endocarditis[J]. Int J Cardiol, 2016, 202: 564-570.
[11]LOPEZ-GIACOMAN S, MADERO M. Biomarkers in chronic kidney disease, from kidney function to kidney damage[J]. World J Nephrol, 2015, 4(1): 57-73.
[12]MOLITORIS B A, MELNIKOV V Y, OKUSA M D, et al. Technology insight: biomarker development in acute kidney injury-what can we anticipate?[J]. Nat Clin Pract Nephrol, 2008, 4(3): 154-165.