表1两组膀胱组织中CD68和VEGF表达平均光密度值![]()
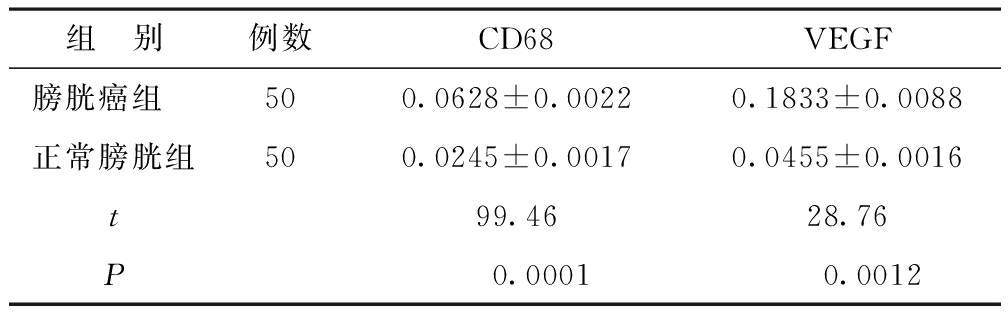
组 别例数CD68VEGF膀胱癌组500.0628±0.00220.1833±0.0088 正常膀胱组500.0245±0.00170.0455±0.0016t99.4628.76P0.00010.0012
膀胱癌是我国泌尿系统最常见的肿瘤之一,是一种直接威胁患者生存的疾病[1]。膀胱癌手术后容易复发、转移,为临床治疗带来难题。肌层浸润性膀胱癌在行根治性膀胱切除后,50%以上的病人会发生转移,5年生存率36%~54%,其发生发展及转移的具体机制亟待进一步研究[2-4]。肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)也称肿瘤组织局部浸润巨噬细胞,在肿瘤组织微环境中发挥着免疫抑制效应,促进瘤内血管新生、肿瘤增殖、侵犯及转移[5-8],目前已经有大量TAMs与肿瘤关系方面的研究,但TAMs在人膀胱癌组织中的表达在国内外尚罕见报道。CD68是一种分子量为110 kDa的糖蛋白,此抗体可作为研究人体多种组织巨噬细胞的标志物;而血管内皮生长因子(vascular endothelial growth factor, VEGF)是一种选择性的内皮细胞有丝分裂原,特异性地作用于血管内皮细胞,促进其增殖,在原位组织诱导血管生长,是肿瘤血管形成过程中的关键因子。本研究以CD68标志肿瘤相关巨噬细胞,拟通过研究CD68及VEGF在膀胱癌组织中及正常膀胱组织中的表达情况,来观察TAMs及VEGF对膀胱癌的影响,从而为膀胱癌的治疗和预后判断提供帮助。
1.1 材料 于深圳市蛇口人民医院和中南大学湘雅二院共收集2015年1月至2016年12月因膀胱肿瘤行手术治疗的50例患者切除的膀胱肿瘤组织及正常膀胱组织(距肿瘤边缘5 cm以外)的标本。患者年龄40~70岁,其中男性32例,女性18例,术后病理回报均为高级别浸润性尿路上皮癌。所有患者术前均未接受任何放疗化疗,组织标本在液氮中常规保存。按照伦理委员会的相关要求,所有患者均术前签署手术标本用于科研的同意书。
1.2 CD68和VEGF的表达测定 采用免疫组化法测定组织中CD68和VEGF的表达。膀胱癌组织及正常膀胱组织进行常规石蜡切片制作,二甲苯脱蜡后进行复水,30 g/L H2O2室温孵育5~10 min消除过氧化物酶(内源性)的活性,采用热修复法进行抗原修复,滴加50 g/L BSA 进行常规封闭30~45 min。分别加入1∶50 稀释的兔抗人一抗(CD68或VEGF),4 ℃冰箱内放置12~18 h。PBS 冲洗后加入聚合 HRP 标记抗兔 IgG,常温避光放置30~45 min,PBS 冲洗,用DAB显色试剂盒显色,再进行常规苏木素染色、脱水透明后封片,采用Image-pro plus 6.0计算平均光密度定量分析TAMs以及VEGF的表达水平。
1.3 统计学分析 采用SPSS 20.0软件对实验数据进行分析,计量资料的比较采用t检验,以P<0.05为差异有统计学意义。
免疫组化结果显示,CD68在正常膀胱组织中表达呈阴性,而在膀胱癌组织中CD68阳性TAMs的数量明显增加,膀胱癌组织的平均光密度值显著高于正常膀胱组织 (P<0.01)(表1,图1);膀胱癌组织中VEGF的平均光密度值显著高于正常膀胱组织 (P<0.01)(表1,图2)。未发现年龄、性别差异对膀胱癌组织中的CD68和VEGF的表达的影响。
表1两组膀胱组织中CD68和VEGF表达平均光密度值![]()

组 别例数CD68VEGF膀胱癌组500.0628±0.00220.1833±0.0088 正常膀胱组500.0245±0.00170.0455±0.0016t99.4628.76P0.00010.0012
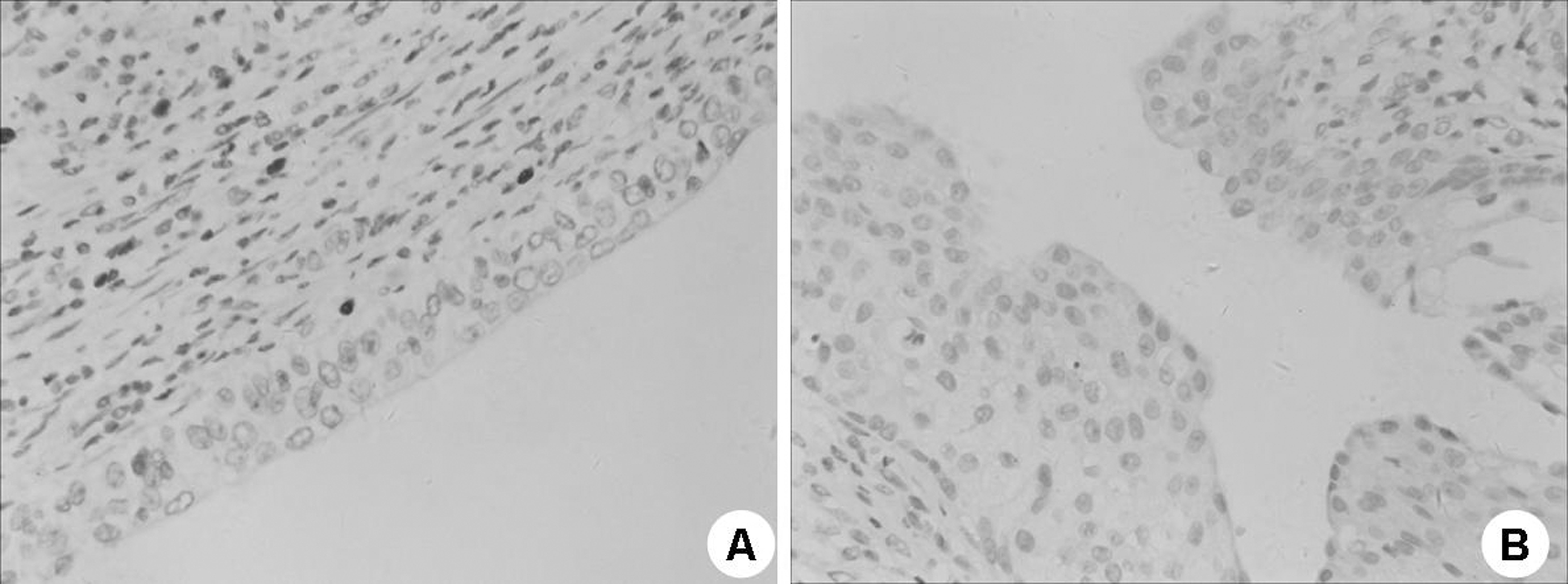
图1 CD68在不同膀胱组织中的表达(免疫组化法×400)
A:膀胱癌组织;B:正常膀胱组织

图2 VEGF在不同膀胱组织中的表达(免疫组化法×400)
A:膀胱癌组织;B:正常膀胱组织
近年来我国膀胱癌发病率呈明显的上升趋势,流行病学研究表明,50%~70%非肌层浸润性膀胱癌在5年内复发,而复发肿瘤中约30%表现为更高级别和浸润性[9-10]。膀胱癌的病因不明,常规病理组织学在膀胱癌诊断方面受到限制[11]。因此研究导致膀胱癌发生发展的相关分子生物学标志物具有重要的意义。最新研究表明,TAMs在实性肿瘤中起着促进肿瘤生长、侵袭及转移的作用[12-14]。
TAMs是指位于肿瘤组织中的M2型巨噬细胞,肿瘤组织间质的大部分由TAMs构成,通过肿瘤微环境影响肿瘤生物学行为和治疗效果。研究表明TAMs可分泌大量的促进血管生成的细胞因子以及一系列调节血管生成的基质金属蛋白酶类,从而促进肿瘤血管生成[15-17]。除了细胞因子和生长因子,TAMs还可以通过表达一些其他介质诱导血管生成促进侵袭转移,如环氧合酶和波形蛋白等[18]。本研究通过免疫组化实验检测了不同膀胱组织中TAMs标志物CD68的表达,结果表明CD68在正常膀胱组织中表达呈阴性,而在膀胱癌组织中CD68阳性TAMs的数量明显。
VEGF是一种细胞有丝分裂原,能诱导血管内皮细胞增殖,并诱导血管生长,是参与血管形成的最重要因子。已有大量研究结果表明,VEGF在肿瘤的发生发展过程中起重要作用。国内外研究显示,肿瘤生长及转移依赖于血管形成[19]。本研究通过免疫组化检测了不同膀胱组织中VEGF蛋白表达水平,结果表明膀胱癌组织中VEGF较正常膀胱组织明显高表达,与国内外研究结果一致。
本研究初步观察到CD68及VEGF在膀胱癌组织及正常膀胱组织中的表达存在差异,提示在膀胱癌组织中TAMs及VEGF明显活跃,故可以推测在膀胱癌组织中也存在类似其他实体肿瘤组织中的TAMs对肿瘤细胞的生长的促进作用。同时有理由相信TAMs对VEGF的形成也可能有促进作用,它通过直接或间接刺激VEGF的形成,诱导血管内皮细胞增殖、活化、迁移,形成新的毛细血管,为肿瘤生长提供营养支持,进而促进了膀胱癌细胞的发生、发展、侵袭和转移。这为下一步深入研究TAMs是如何刺激VEGF的分泌,以及如何阻断TAMs对VEGF的促进作用提供了实验基础,从而可能对膀胱癌的预防及治疗产生深远的影响。总之,TAMs及VEGF在膀胱癌的发生及发展中的相互关系值得进一步研究。
[1]ZHANG X Y, ZHANG Y D. Bladder cancer and genetic mutations[J]. Cell Biochem Biophys, 2015, 73(1): 65-69.
[2]LIU Z, TIAN Q Y, XIA S Y, et al. Evaluation of the improved tubeless cutaneous ureterostomy technique following radical cystectomy in cases of invasive bladder cancer complicated by peritoneal metastasis[J]. Oncol Lett, 2016, 11(2): 1401-1405.
[3]MUTO G, COLLURA D, SIMONE G, et al. Stapled orthotopic ileal neobladder after radical cystectomy for bladder cancer: Functional results and complications over a 20-year period[J]. EJSO, 2016, 42(3): 412-418.
[4]BRUINS H M, ABEN K K, ARENDS T J, et al. The effect of the time interval between diagnosis of muscle-invasive bladder cancer and radical cystectomy on staging and survival: A Netherlands Cancer Registry analysis[J]. Urologic Oncology: Seminars and Original Investigations, 2016, 34(4): 166.e1-166.e6.
[5]BADAWI M, ABOUELFADL D M, EL-SHARKAWY S L, et al. Tumor-associated macrophage(TAM)and angiogenesis in human colon carcinoma[J]. Open Access Maced J Med Sci, 2015, 3(2): 209-214.
[6]ZHANG J, YAO H M, SONG G, et al. Regulation of epithelial-mesenchymal transition by tumor-associated macrophages in cancer[J]. Am J Transl Res, 2015, 7(10): 1699-1711.
[7]易竹君,周赟,张文锋,等.过表达RIPRIP140的肿瘤相关巨噬细胞抑制肝癌细胞的侵袭和增殖[J].南方医科大学学报,2016,36(11):1461-1467.
[8]YAMAGUCHI T, FUSHIDA S, YAMAMOTO Y A, et al. Tumor-associated macrophages of the M2 phenotype contribute to progression in gastric cancer with peritoneal dissemination[J]. Gastric Cancer, 2016, 19(4): 1052-1065.
[9]MA T, WANG W, JIANG Z, et al. Narrow band imaging-assisted holmium laser resection reduced the recurrence rate of non-muscle invasive bladder cancer: a prospective, randomized controlled study[J]. Zhonghua Yi Xue Za Zhi, 2015, 95(37): 3032-3035.
[10]YAN J, SHEN P, ZHENG J, et al. Clinical correlation between serum YKL-40 protein level and recurrence of non-muscle invasive bladder cancer[J]. Ann Transl Med, 2015, 3(22): 354-366.
[11]BEARDO V P, PÉREZ PÉREZ A B, CASTRO D M, et al. Effectiveness of a program of early instillation single chemotherapy in patients with bladder cancer[J]. Rev Calid Asist, 2016, 31(4): 234-238.
[12]CONDE J, BAO C C, TAN Y Q, et al. Dual targeted immunotherapy via in vivo delivery of biohybrid RNAi-peptide nanoparticles to tumor-associated macrophages and cancer cells[J]. Adv Funct Mater, 2015, 25(27): 4183-4194.
[13]ZHANG C, HU X, LIU X Y, et al. Effect of tumor-associated macrophages on gastric cancer stem cell in omental milky spots and lymph node micrometastasis[J]. Int J Clin Exp Pathol, 2015, 8(11): 13795-13805.
[14]DING H X, ZHAO L M, DAI S L, et al. CCL5 secreted by tumor associated macrophages may be a new target in treatment of gastric cancer[J]. Biomedicine & Pharmacotherapy, 2016, 77: 142-149.
[15]SHEN Z L, YAN Y C, YE C X, et al. The effect of vasohibin-1 expression and tumor-associated macrophages on the angiogenesis in vitro and in vivo[J]. Tumor Biology, 2016, 37(6): 7267-7276.
[16]BRANDELLI J R, GRIENER T P, LAING A A, et al. The effects of shiga toxin 1, 2 and their subunits on cytokine and chemokine expression by human macrophage-like THP-1 cells[J]. Toxins (Basel), 2015, 7(10): 4054-4066.
[17]ALMATROODI S A, MCDONALD C F, DARBY I A, et al. Characterization of M1/M2 tumour-associated macrophages(TAMs)and Th1/Th2 cytokine profiles in patients with NSCLC[J]. Cancer Microenviron, 2016, 9(1): 1-11.
[18]LI H Z, YANG B, HUANG J, et al. Cyclooxygenase-2 in tumor-associated macrophages promotes breast cancer cell survival by triggering a positive-feedback loop between macrophages and cancer cells[J]. Oncotarget, 2015, 6(30): 29637-29650.
[19]ZHAO J, ZHANG Z R, ZHAO N, et al. VEGF silencing inhibits human osteosarcoma angiogenesis and promotes cell apoptosis via PI3K/AKT signaling pathway[J]. Cell Biochem Biophys, 2015, 73(2): 519-525.