躯体症状既是躯体组织器官对外界的诉求,又是缓解内心冲突的途径,是负性情绪本身,也是暗示、自我暗示的结果,还是个体对躯体感受的负性解读。基于前期临床实践的研究,我们发现临床工作中所遇到的躯体症状可分为生物性躯体症状、情绪性躯体症状(抑制性躯体症状和激惹性躯体症状)、认知性躯体症状、想象性躯体症状4类。其中情绪性躯体症状可表现为抑制性症状,如便秘、消化不良等器官功能抑制的表现,也可表现为激惹性症状,如肠激惹综合征、恶心呕吐、疼痛等组织器官局部激惹而出现的功能紊乱表现。根据各类症状的不同特点,我们开发出相应的评估工具《WCPA临床躯体症状分类量表》[1],该量表已经被证实具有良好的信效度。我们在使用该量表进行的医学临床多中心现场测试研究中发现,激惹性的情绪性躯体症状是在各个科室出现频率最高的症状[2]。
激惹性躯体症状表现为局部器官功能的紊乱,核心实际是焦虑。近年来,焦虑的生理特征变化也引起较多关注。随着神经内分泌研究的发展,发现下丘脑-垂体-肾上腺轴(hypothalamus-pituitary-adrenal axis,HPA轴)和下丘脑-垂体-甲状腺轴(hypothalamic-pituitary-thyroid axis,HPT轴)与精神活动和行为有密切关系。目前公认的慢性应激可显著活化HPA轴,消极情绪如恐惧、焦虑与HPA轴功能紊乱密切相关,可以造成血清皮质醇水平异常[3]。焦虑与HPT轴的相关性则存在争议。本研究旨在分析激惹性躯体症状患者HPA及HPT轴的内分泌特点及人格特点,探讨症状严重程度与各项内分泌指标的相关性,并探讨抗焦虑治疗对于神经内分泌轴的影响,分析其相关性。
1 对象与方法
1.1 病例来源 2014年8月至2015年2月全国13个学科,共计61个科室、524例患者。将符合纳入标准、排除标准的被试者进行《WCPA临床躯体症状分类量表》测试,筛选出以激惹性躯体症状评分较高的患者群,共161例,其中:男56例,女103例,2例性别缺失。
纳入标准:年龄18~65岁的中国男性和女性,不论现有诊断,各科慢性非感染性疾病中有非单一躯体主诉的患者,具有“医学上不能解释的症状”的患者,对躯体症状过分关注、感到痛苦、社会功能受到影响的患者,经WCPA躯体症状量表筛选出激惹性躯体因子分较高者。
排除标准:急性感染、急性创伤、围手术期、慢性病急性发作期患者,躯体症状不符合现行医学诊断标准并已针对躯体症状进行诊断性治疗的患者,病情危重或临终的患者,妊娠或哺乳期妇女,物质滥用者。
1.2 研究方法 本研究采用便利取样法,选取符合本研究入组标准的被试者,遵循自愿参加的原则,被试者签订知情同意书后,采用我们自编的《WCPA临床躯体症状分类量表》进行测试,根据躯体症状量表筛选出激惹性躯体症状因子分较高的患者,给予推荐的抗焦虑药物方案的治疗。分别在基线、4周末、12周末进行评估,评估被试者的躯体症状严重程度及内分泌指标。
工具采用《WCPA躯体症状分类量表》,该量表的理论背景和指导思想为孙学礼教授在心身医学理论下提出的临床躯体症状分类理论。问卷包含生物性躯体症状、情绪性躯体症状、认知性躯体症状和想象性躯体症状4个维度,其中情绪性躯体症状又分为激惹性躯体症状和抑制性躯体症状2个亚型。量表包含55个题项,评分采取0~4五级评分,主要评估近2周来患者躯体症状对其影响程度,“0”表示从无,“1”表示轻度,“2”表示中度,“3”表示偏重,“4”表示严重。总分越高,表明症状越严重。因子分=该因子的各项目总分/项目数,某因子分较高则表明相应的躯体症状为主要症状,次高分为该被试者的次级症状。其信度经过严格科学检验,问卷的α系数为0.824,1周后重测信度为0.824,分半信度为0.922。测试为患者自评(p)和医生他评(d)两个部分相结合,在多中心现场调查前,已对所有参研单位进行包括项目理论假设、症状评估工具、临床试验内容及操作方法在内的集中培训,内部一致性较好。
1.3 统计学方法 采用Epidate 3.0建立数据库,集中进行数据录入,采用SPSS 21.0软件进行统计分析。正态分布的计量资料用均数±标准差表示,治疗前后多组均数间的比较采用重复测量的方差检验,相关分析采用Pearson(两者均为正态分布)或Spearman(两者不满足正态分布)相关性分析。P<0.05表示差异有统计学意义。
2 结 果
收集有效病例共524例,通过治疗前第一次评估躯体症状分类量表,根据因子分较高者进行分型,其中激惹性躯体症状因子得分较高的病例分型为“激惹性躯体症状”患者群,筛选出患者共161例,在5个亚型中占30.7%。
2.1 激惹型躯体症状患者的躯体症状分值变化 96例进行了基线、4周末、12周末的测量,41例进行了基线、4周末的测量,2例仅进行了基线、12周末的测量,36例仅进行了基线测量。躯体症状得分的各个维度及总分在基线、4周末、12周末均出现下降的趋势,均有统计学差异(P<0.01)。见表1。
表1 激惹型躯体症状患者的躯体症状分值变化
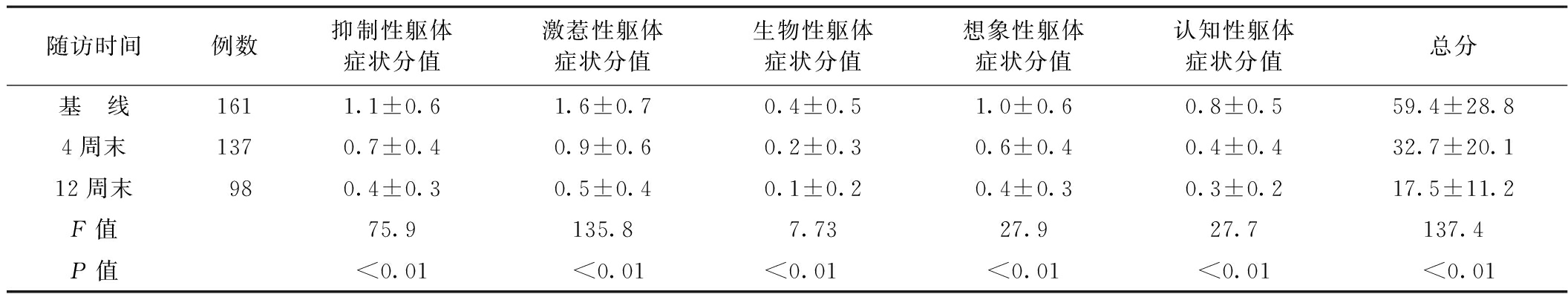
随访时间例数抑制性躯体症状分值激惹性躯体症状分值生物性躯体症状分值想象性躯体症状分值认知性躯体症状分值总分基 线1611.1±0.61.6±0.70.4±0.51.0±0.60.8±0.559.4±28.84周末1370.7±0.40.9±0.60.2±0.30.6±0.40.4±0.432.7±20.112周末980.4±0.30.5±0.40.1±0.20.4±0.30.3±0.217.5±11.2F值75.9135.87.7327.927.7137.4P值<0.01<0.01<0.01<0.01<0.01<0.01
2.2 激惹性躯体症状患者的激素变化 每次随访时对患者的相关激素进行测量,主要包括:TSH、FT3、FT4、TT3、TT4、皮质醇、ACTH。各激素基线及4周末测量值比较,发现TT3随时间推移升高,其变化有统计学意义(P<0.05),其余HPT轴激素及皮质醇、ACTH变化无统计学意义(P>0.05)。见表2。
表2 激惹型躯体症状的患者HPT激素变化
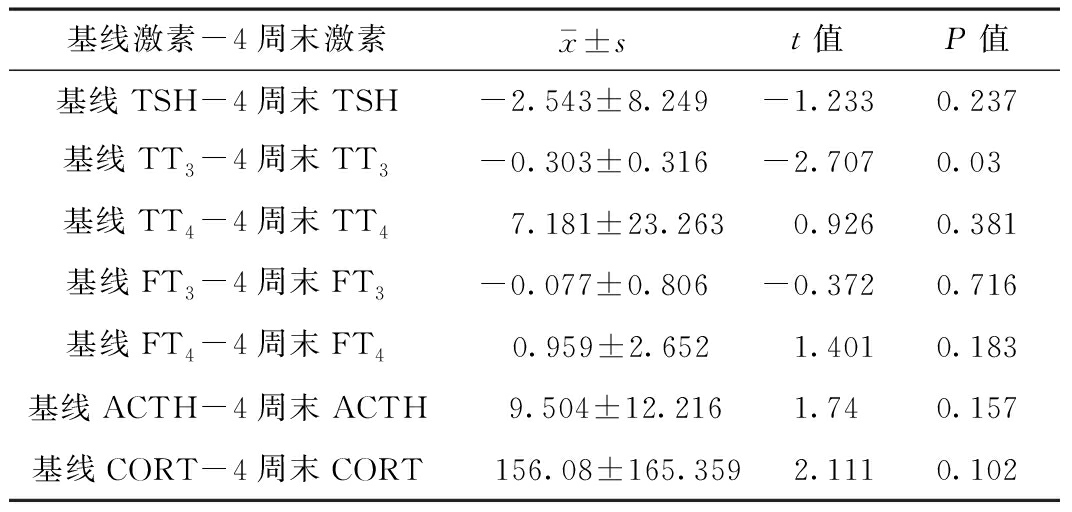
基线激素-4周末激素x-±st值P值基线TSH-4周末TSH-2.543±8.249-1.2330.237基线TT3-4周末TT3-0.303±0.316-2.7070.03基线TT4-4周末TT47.181±23.2630.9260.381基线FT3-4周末FT3-0.077±0.806-0.3720.716基线FT4-4周末FT40.959±2.6521.4010.183基线ACTH-4周末ACTH9.504±12.2161.740.157基线CORT-4周末CORT156.08±165.3592.1110.102
2.3 内分泌激素与躯体症状量表总分的相关性
2.3.1 基线总分与激素相关性分析 临床躯体症状分类量表基线总分和任何激素都没有统计学的相关性(用Pearson积矩相关系数描述两变量之间的直线关系的相关方向和密切程度)。
2.3.2 4周末量表总分减分率与激素变化之间的关系
2.3.2.1 减分率与HPT轴激素变化之间的关系 治疗4周后,临床躯体症状分类量表评分与HPT轴激素的统计学相关性分析(用Pearson积矩相关系数描述两变量之间的直线关系的相关方向和密切程度)显示,TT3变化与减分率的关系有统计学意义(P<0.05)。见表3。
表3 量表减分率与HPT轴激素变化之间的关系
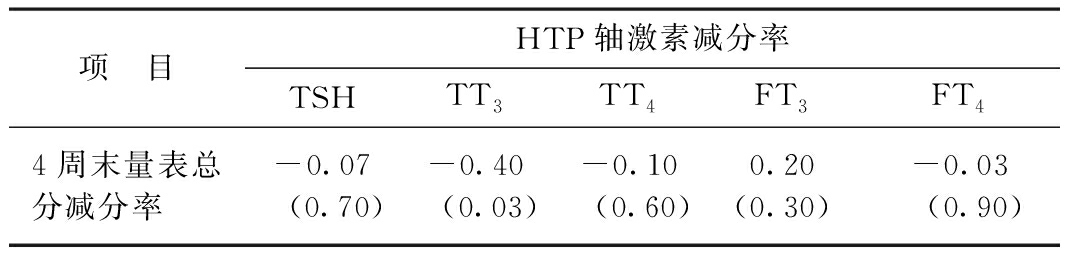
项 目HTP轴激素减分率TSHTT3TT4FT3FT44周末量表总分减分率-0.07(0.70)-0.40(0.03)-0.10(0.60)0.20(0.30)-0.03(0.90)
2.3.2.2 减分率与TT3激素变化之间的关系 对第4周末躯体症状量表总分及TT3激素的值较基线求减分率,并对其进行线性回归,结果显示两者呈负相关(r=-0.5,P=0.012)。
2.3.2.3 减分率与HPA轴激素变化之间的关系 治疗4周后临床躯体症状分类量表评分和HPA轴激素都无统计学的相关性(用Pearson积矩相关系数描述两变量之间的直线关系的相关方向和密切程度)。
3 讨 论
人作为一个整体,情绪与神经系统、内分泌系统都是紧密相连的。随着神经内分泌研究的进展,我们已知,消极情绪如恐惧、焦虑的情绪与HPA轴功能紊乱密切相关。而激惹性躯体症状的核心实际是躯体性焦虑,在本研究中,主要发现该患者群ACTH升高较明显,提示激惹性躯体症状患者的HPA轴功能亢进。这可能与应激导致HPA轴激活有关,也与脑内5-HT和NE有关,当患者脑内5-HT低下时,垂体ACTH会分泌增加。HPT轴与HPA轴之间存在密切联系,不可割裂开来,HPT轴的失调可能是对中枢5-HT的活性降低的补偿机制[4],也可能是受到HPA轴的影响所致。Simon等[5]认为,甲状腺功能紊乱在广泛性焦虑障碍及惊恐障碍患者中较常见。尹红蕾等[6]的研究发现,焦虑症患者的血浆TSH水平明显高于对照组,焦虑症患者的HPT轴有明显激活。Kikuchi等[7]对66例未经治疗的惊恐障碍患者进行甲功检查,发现症状严重程度与TSH关系较大。而我们的发现主要集中在T3低于正常,反映了患者的HPT轴功能不稳定。
激惹性躯体症状表现为组织器官功能紊乱,在临床非精神科有不同的名字,如 “肠易激综合征(irritable bowel syndrome,IBS)”“不明原因的慢性疼痛”等。以IBS为例,研究发现中枢神经系统和肠神经系统之间的通信是双向的:大脑可以影响肠神经系统的功能,肠道可通过迷走神经和交感神经传入影响大脑[8]。在IBS患者中,HPA轴和交感神经系统功能出现紊乱,其基础皮质醇水平增高,血浆ACTH水平下降[9]。近年来越来越多的研究提示情绪障碍与慢性疼痛存在着一系列共同的神经生物学机制,也同时存在HPA轴异常[10]。而这些发现,使不同的症状间有着相同的神经内分泌特征,是否也从另外一方面印证了躯体症状这样分类的正确性,这为临床工作带来一些新的提示。
本研究还发现,经正规抗焦虑方案治疗后,比较患者治疗前后的内分泌轴情况,发现治疗前有异常的内分泌指标,如ACTH和T3在治疗12周后均趋于正常。目前治疗主要选择SSRI、SNRI类药物,主要是因为该类药物可选择性抑制5-HT和(或)NE再摄取,提高突触间隙5-HT和(或)NE的浓度,起到抗焦虑、抗抑郁作用,这些药物均能降低HPA轴活性。如费慧芝等[11]在2012年作大鼠实验发现帕罗西汀可以降低HPA轴活性。其他动物实验也表明,用抗抑郁药丙咪嗪注入甲亢大鼠腹腔,将显著降低血清的FT4,也随之降低其抑郁和焦虑样行为[12]。在人类的临床观察也发现类似情况。Plag 等[13]认为,抗焦虑药物的干预可能会影响患者HPA轴的激素分泌。有报道在60岁以上广泛性焦虑障碍的患者中使用SSRI类药物艾司西酞普兰可降低血清皮质醇,降低HPA轴兴奋性从而改善焦虑[14]。而为何我们会观察到甲状腺指标也在变化,可能与HPA轴对HPT轴的影响有关。高皮质醇可抑制TSH的分泌和甲状腺素的外周转化,可能导致T3降低,在HPA轴功能逐渐恢复正常后,甲状腺指标也可趋于好转。
本研究具有良好的临床指导意义,其一是继续普及“大医学”的观念,带动多学科以心身统一的观点来看待躯体症状;其二是在多中心的合作中继续验证WCPA临床躯体症状分类量表的正确性;其三是通过选择目前出现频率较高的激惹性躯体症状来说明,神经内分泌指标在躯体症状的分类、判定疗效及预后等方面可能具有重要意义,待继续开展更多现场调查后,逐步发现其他躯体症状的神经内分泌轴变化特点。
本研究的缺点是,能坚持随访的样本量较少,仅能提供一种趋势。今后有待继续开展多中心合作纳入更多患者,作出更大样本的现场测试来进一步证实。
[1]ZENG F M, SUN X L, YANG B X, et al. The theoretical construction of a classification of clinical somatic symptoms in psychosomatic medicine theory[J]. PLoS One, 2016, 11(8): e0161222.
[2]孙学礼,曾凡敏.临床躯体症状的心身医学分类及诊疗共识[M].北京:科学出版社,2015.
[3]BUCHANAN T W. AL′ABSI M, LOVALLO W R. Cortisol fluctuates with increases and decreases in negative affect[J]. Psychoneuroendocrinology, 1999, 24(2): 227-241.
[4]DUVAL F, MOKRANI M C, MONREAL J, et al. Interaction between the serotonergic system and HPA and HPT axes in patients with major depression: implications for pathogenesis of suicidal behavior[J]. Dialogues Clin Neurosci, 2002, 4(4): 417.
[5]SIMON N M, BLACKER D, KORBLY N B, et al. Hypothyroidism and hyperthyroidism in anxiety disorders revisited: new data and literature review[J]. J Affect Disord, 2002, 69(1/3): 209-217.
[6]尹红蕾,洪军,薛湘,等.焦虑症患者皮质醇、甲状腺激素及自主神经功能的对照研究[J].中华行为医学与脑科学杂志,2011,20(11):1025-1028.
[7]KIKUCHI M, KOMURO R, OKA H, et al. Relationship between anxiety and thyroid function in patients with panic disorder[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2005, 29(1): 77-81.
[8]STASI C, ROSSELLI M, BELLINI M, et al. Altered neuro-endocrine-immune pathways in the irritable bowel syndrome: the top-down and the bottom-up model[J]. J Gastroenterol, 2012, 47(11): 1177-1185.
[9]周正华,马玲玲.肠易激综合征与神经-内分泌-免疫网络关系[J].中国中西医结合消化杂志,2013,21(2):106-109.
[10]刘玉娇,周洪海,王承敏,等.甲状腺激素及抗体与抑郁症的相关性[J].神经疾病与精神卫生,2015(4):368-371.
[11]费慧芝,王涵,胡小娅,等.帕罗西汀抗抑郁作用涉及改善氧化应激状态、HPA轴功能和海马脑源性神经营养因子表达[J].中国临床药理学与治疗学,2012,17(10):1137-1142.
[12]余大富.甲状腺素对大鼠抑郁和焦虑样行为以及背景恐惧记忆的影响[D].昆明:云南大学,2015:10-73.
[13]PLAG J, SCHUMACHER S, SCHMID U, et al. Baseline and acute changes in the HPA system in patients with anxiety disorders: the current state of research[J]. Neuropsychiatry, 2013, 3(1): 45-62.
[14]LENZE E J, MANTELLA R C, SHI P C, et al. Elevated cortisol in older adults with generalized anxiety disorder is reduced by treatment: a placebo-controlled evaluation of escitalopram[J]. Am J Geriatr Psychiatry, 2011, 19(5): 482-490.