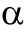 (HIF-1
(HIF-1 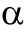 )能与
)能与 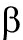 亚基结合形成二聚体复合物,调节下游基因的表达参与低氧适应、机体炎症反应、免疫调节等,在急性肺损伤中发挥重要作用。本文就NF-
亚基结合形成二聚体复合物,调节下游基因的表达参与低氧适应、机体炎症反应、免疫调节等,在急性肺损伤中发挥重要作用。本文就NF-  B/HIF-1
B/HIF-1 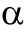 、ROS/HIF-1
、ROS/HIF-1 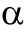 、腺苷A2/HIF-1
、腺苷A2/HIF-1 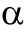 途径与急性肺损伤发病机制的研究进展进行综述。
途径与急性肺损伤发病机制的研究进展进行综述。 江林敏 1 ,熊 彬 2 ,李 多 2
(1.西南医科大学,四川 泸州 646000;2.西南医科大学附属医院,四川 泸州 646000)
【 摘要 】 低氧诱导因子1 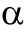 (HIF-1
(HIF-1 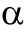 )能与
)能与 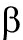 亚基结合形成二聚体复合物,调节下游基因的表达参与低氧适应、机体炎症反应、免疫调节等,在急性肺损伤中发挥重要作用。本文就NF-
亚基结合形成二聚体复合物,调节下游基因的表达参与低氧适应、机体炎症反应、免疫调节等,在急性肺损伤中发挥重要作用。本文就NF-  B/HIF-1
B/HIF-1 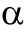 、ROS/HIF-1
、ROS/HIF-1 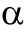 、腺苷A2/HIF-1
、腺苷A2/HIF-1 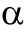 途径与急性肺损伤发病机制的研究进展进行综述。
途径与急性肺损伤发病机制的研究进展进行综述。
【 关键词 】 低氧诱导因1 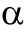 ;急性肺损伤;核因子-
;急性肺损伤;核因子-  B;活性氧;腺苷A2
B;活性氧;腺苷A2
低氧诱导因子(HIF)是缺氧时哺乳动物体内产生的重要转录调节因子,是由HIF-  和HIF-
和HIF- 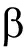 两个亚基组成的异二聚体。HIF有不同的
两个亚基组成的异二聚体。HIF有不同的  亚基(HIF-1
亚基(HIF-1  、HIF-2
、HIF-2  和 HIF-3
和 HIF-3  )、相同的
)、相同的 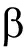 亚基。HIF-
亚基。HIF- 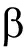 是HIF家族成员的共同亚基,属于结构性表达亚基,在细胞核中持续表达,不受氧浓度调节和影响;HIF-1
是HIF家族成员的共同亚基,属于结构性表达亚基,在细胞核中持续表达,不受氧浓度调节和影响;HIF-1  是氧调节蛋白,属于功能性亚基,在常氧下降解,而在低氧时广泛表达。文献表明 [1] ,在氧浓度>5%时,HIF-1
是氧调节蛋白,属于功能性亚基,在常氧下降解,而在低氧时广泛表达。文献表明 [1] ,在氧浓度>5%时,HIF-1  基因上的氧依赖结构域(ODDD)经脯氨酰羟化酶(PHD)羟基化后,通过与泛素E3连接酶pVHL蛋白结合,然后被蛋白酶所降解。然而在氧浓度<5%条件下,脯氨酰羟化酶(PHD)的活性本身会被抑制,线粒体的电子传递链也会受到抑制,另一方面由于其代谢产物乳酸、丙酮酸等堆积,也会抑制脯氨酰羟化酶,使HIF-1
基因上的氧依赖结构域(ODDD)经脯氨酰羟化酶(PHD)羟基化后,通过与泛素E3连接酶pVHL蛋白结合,然后被蛋白酶所降解。然而在氧浓度<5%条件下,脯氨酰羟化酶(PHD)的活性本身会被抑制,线粒体的电子传递链也会受到抑制,另一方面由于其代谢产物乳酸、丙酮酸等堆积,也会抑制脯氨酰羟化酶,使HIF-1  降解减少而稳定表达,转入细胞核内,与HIF-1
降解减少而稳定表达,转入细胞核内,与HIF-1 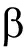 亚基结合;然后通过与转录共同活化因子CBP和 p300的结合,启动子低氧反应元件(HRE)基因的表达。而目前已知的HIF-1
亚基结合;然后通过与转录共同活化因子CBP和 p300的结合,启动子低氧反应元件(HRE)基因的表达。而目前已知的HIF-1  靶基因有50多种,包括血管内皮生长因子(VEGF)、诱导性一氧化氮酶(iNOS)、促红细胞生成素(EPO)、葡萄糖转运子(GLUT)、CD39、CD73等多种靶基因的表达。
靶基因有50多种,包括血管内皮生长因子(VEGF)、诱导性一氧化氮酶(iNOS)、促红细胞生成素(EPO)、葡萄糖转运子(GLUT)、CD39、CD73等多种靶基因的表达。
急性肺损伤是危重病人常见的一种临床综合征,也是危重病人死亡的常见病因,其主要临床表现是顽固性低氧血症及呼吸衰竭,而其发病机制主要是多种炎细胞(巨噬细胞、中性粒细胞、血管内皮细胞、血小板)及其释放的炎性细胞因子介导的炎症反应,导致的肺微血管通透性增高、肺泡腔渗出液体进一步导致非心源性肺水肿。虽然肺是机体含氧最丰富的器官,但在急性肺损伤发生时,炎症引起肺泡上皮细胞以及血管内皮细胞的破坏,肺的通气换气功能受影响,肺组织细胞的氧分压会迅速降低,从而使机体启动低氧反应,表达低氧诱导因子HIF-1  ,而HIF-1
,而HIF-1  则进一步调节靶基因的表达参与急性肺损伤的发生发展 [2] 。由于目前急性肺损伤的发病机制不完全清楚,致使临床上没有特异性的治疗方法,因此寻找新的有效治疗方法迫在眉睫,本文就HIF-1
则进一步调节靶基因的表达参与急性肺损伤的发生发展 [2] 。由于目前急性肺损伤的发病机制不完全清楚,致使临床上没有特异性的治疗方法,因此寻找新的有效治疗方法迫在眉睫,本文就HIF-1  在急性肺损伤发病机制中的研究进展做一综述,以期为急性肺损伤的治疗探索新途径。
在急性肺损伤发病机制中的研究进展做一综述,以期为急性肺损伤的治疗探索新途径。
 相关的急性肺损伤发病机制
相关的急性肺损伤发病机制 1.1 NF- 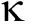 B/HIF-1
B/HIF-1  途径与急性肺损伤机制 无论是肺内直接因素或肺外间接因素导致的肺损伤,炎症细胞的活化聚集和炎症介质的释放产生的全身炎症反应综合征(SIRS)是肺损伤发生发展的重要病理生理过程,而NF-
途径与急性肺损伤机制 无论是肺内直接因素或肺外间接因素导致的肺损伤,炎症细胞的活化聚集和炎症介质的释放产生的全身炎症反应综合征(SIRS)是肺损伤发生发展的重要病理生理过程,而NF- 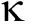 B作为炎症反应的调节中枢,通常可以通过内毒素(LPS)、细胞表面抗原识别模式(PMBPS)、TLR4途径启动细胞的炎症反应,在肺组织中高度表达 [3] 。目前的研究表明NF-
B作为炎症反应的调节中枢,通常可以通过内毒素(LPS)、细胞表面抗原识别模式(PMBPS)、TLR4途径启动细胞的炎症反应,在肺组织中高度表达 [3] 。目前的研究表明NF- 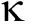 B与低氧诱导因子(HIF-1
B与低氧诱导因子(HIF-1  )有着密不可分的相互联系。Cummins等 [4] 的研究表明缺氧条件下PHD被抑制,而PHD负调控I
)有着密不可分的相互联系。Cummins等 [4] 的研究表明缺氧条件下PHD被抑制,而PHD负调控I 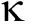 B激酶
B激酶 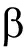 ,使I
,使I 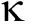 B蛋白磷酸化从而被降解,释放被抑制的NF-
B蛋白磷酸化从而被降解,释放被抑制的NF- 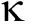 B。同时HIF-1
B。同时HIF-1  可以影响NF-
可以影响NF- 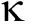 B的表达。Scortegagna等 [5] 的研究表明,在过度表达HIF-
B的表达。Scortegagna等 [5] 的研究表明,在过度表达HIF-  的小鼠角化细胞中,NF-
的小鼠角化细胞中,NF- 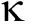 B水平也明显增高,炎症反应强烈。另一方面,NF-
B水平也明显增高,炎症反应强烈。另一方面,NF- 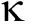 B可以直接调节HIF-1
B可以直接调节HIF-1  mRNA的转录,可以使HIF-1
mRNA的转录,可以使HIF-1  表达增多及在缺氧环境中的稳定性增加。Souza等 [6] 的实验发现在LPS作用于巨噬细胞模型中,棕榈油酸可以通过下调NF-
表达增多及在缺氧环境中的稳定性增加。Souza等 [6] 的实验发现在LPS作用于巨噬细胞模型中,棕榈油酸可以通过下调NF- 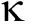 B从而发挥抗炎作用,同时巨噬细胞中TLR4、MYD88、capase-1、HIF-1
B从而发挥抗炎作用,同时巨噬细胞中TLR4、MYD88、capase-1、HIF-1  等因子也减少,有氧糖酵解被抑制。Pallssob-Mcdermott等 [7] 的实验也证明抑制丙酮酸激酶2(PKM2),可以下调HIF-1
等因子也减少,有氧糖酵解被抑制。Pallssob-Mcdermott等 [7] 的实验也证明抑制丙酮酸激酶2(PKM2),可以下调HIF-1  的表达,促进巨噬细胞向M2型极化,增加抗炎因子IL-10的表达,达到抗炎的作用。也就是说,HIF-1
的表达,促进巨噬细胞向M2型极化,增加抗炎因子IL-10的表达,达到抗炎的作用。也就是说,HIF-1  本身会调节巨噬细胞等炎症细胞介导的炎症反应。
本身会调节巨噬细胞等炎症细胞介导的炎症反应。
1.2 ROS/HIF-1  途径与急性肺损伤机制 活性氧簇(ROS)是生物体内一系列高活性的含氧化合物的总称,生理状况下,生物体内产生的ROS通过由超氧化物歧化酶(SOD)、过氧化氧酶、谷胱甘肽过氧化物酶等组成的抗氧化体系消除,而在炎症等病理状况下,ROS产生增加,同时机体抗氧化酶活性下降,导致ROS在细胞内的积累。而积累的ROS又可以作用于多种大分子物质,如引起多种功能蛋白的损伤、DNA损伤、脂质过氧化等,促进急性肺损伤的病理发展。
途径与急性肺损伤机制 活性氧簇(ROS)是生物体内一系列高活性的含氧化合物的总称,生理状况下,生物体内产生的ROS通过由超氧化物歧化酶(SOD)、过氧化氧酶、谷胱甘肽过氧化物酶等组成的抗氧化体系消除,而在炎症等病理状况下,ROS产生增加,同时机体抗氧化酶活性下降,导致ROS在细胞内的积累。而积累的ROS又可以作用于多种大分子物质,如引起多种功能蛋白的损伤、DNA损伤、脂质过氧化等,促进急性肺损伤的病理发展。
研究表明缺氧本身可以通过影响线粒体电子传递复合体,导致细胞内ROS水平升高 [8] 。同时缺氧通过NADPH氧化酶、黄嘌呤氧化酶等增加ROS水平。Ma等 [9] 的实验发现,白藜芦可以通过抑制HIF-1  从而抑制酒精性脂肪肝小鼠线粒体产生的ROS,起到抗氧化、抗炎的治疗作用,而产生的ROS又是使HIF-1
从而抑制酒精性脂肪肝小鼠线粒体产生的ROS,起到抗氧化、抗炎的治疗作用,而产生的ROS又是使HIF-1  稳定表达的必要条件。一项关于LPS所致大鼠急性肺损伤的实验表明 [10] ,汉黄芩素可以通过抑制HIF-1
稳定表达的必要条件。一项关于LPS所致大鼠急性肺损伤的实验表明 [10] ,汉黄芩素可以通过抑制HIF-1  和NNF-
和NNF- 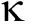 B减少氧化应激相关酶SOD、MAT,以及炎症因子TNF
B减少氧化应激相关酶SOD、MAT,以及炎症因子TNF  、IL-1
、IL-1 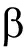 ,从而产生和地塞米松治疗急性肺损伤相似的作用,但副作用更少。
,从而产生和地塞米松治疗急性肺损伤相似的作用,但副作用更少。
1.3 腺苷A2/HIF-1  与急性肺损伤机制 虽然肺损伤是危急重症,但大多数的肺损伤可以通过机械通气自发好转,因此有研究通过重复的机械牵张肺泡内皮细胞模拟机械通气,发现牵拉肺泡上皮细胞可以通过抑制琥珀酸盐脱氢酶(SDH)的激活,抑制PHD酶的活性途径,使HIF-1
与急性肺损伤机制 虽然肺损伤是危急重症,但大多数的肺损伤可以通过机械通气自发好转,因此有研究通过重复的机械牵张肺泡内皮细胞模拟机械通气,发现牵拉肺泡上皮细胞可以通过抑制琥珀酸盐脱氢酶(SDH)的激活,抑制PHD酶的活性途径,使HIF-1  在机械通气条件下稳定表达 [10] 。研究表明,由于CD73是HIF-1
在机械通气条件下稳定表达 [10] 。研究表明,由于CD73是HIF-1  的靶基因之一,低氧诱导因子可以通过CD73促进ATP/AMP转化为腺苷,激活腺苷通路。
的靶基因之一,低氧诱导因子可以通过CD73促进ATP/AMP转化为腺苷,激活腺苷通路。
腺苷是参与细胞代谢活动、酶反应、细胞修复等过程的重要细胞因子之一。其中腺苷A2B受体可以在炎症反应、缺血、缺氧等病理状况下被激活,进一步激活腺苷酸环化酶(AC),产生细胞第二信使,发挥抗炎作用 [11] 。Hart等 [12] 研究大鼠小肠缺血再灌注模型也发现HIF-1  激活剂DOMG可以产生保护性作用,而在缺乏腺苷A2B受体的大鼠体内却不能。Thiel等 [13] 研究细菌感染的大鼠在吸入100%纯氧情况下比吸入21%常氧情况下的大鼠病死率高5倍,考虑可能减少了腺苷的抗炎作用,扩大了肺部损伤。
激活剂DOMG可以产生保护性作用,而在缺乏腺苷A2B受体的大鼠体内却不能。Thiel等 [13] 研究细菌感染的大鼠在吸入100%纯氧情况下比吸入21%常氧情况下的大鼠病死率高5倍,考虑可能减少了腺苷的抗炎作用,扩大了肺部损伤。
1.4 HIF-1  与急性肺损伤其他机制 Eckle等 [14] 先后通过DOMG(PHD抑制剂)和棘霉素(阻止HIF与靶基因DNA的结合)作用于模拟的急性肺损伤模型,发现激活HIF-1
与急性肺损伤其他机制 Eckle等 [14] 先后通过DOMG(PHD抑制剂)和棘霉素(阻止HIF与靶基因DNA的结合)作用于模拟的急性肺损伤模型,发现激活HIF-1  可以减少肺水肿和气体交换障碍,并减少炎症的产生。其主要机制可能为:增加的糖酵解和三羧酸循环及缺氧调节下优化的线粒体功能会产生更多的ATP,为机体免疫细胞提供更多的能量,同时减少ROS的积累及导致的危害。Nagamine 等 [15] 研究通过DOMG作用于大鼠的肺泡上皮细胞,则发现激活HIF-1
可以减少肺水肿和气体交换障碍,并减少炎症的产生。其主要机制可能为:增加的糖酵解和三羧酸循环及缺氧调节下优化的线粒体功能会产生更多的ATP,为机体免疫细胞提供更多的能量,同时减少ROS的积累及导致的危害。Nagamine 等 [15] 研究通过DOMG作用于大鼠的肺泡上皮细胞,则发现激活HIF-1  可以通过抑制Fas/FasL、减轻caspase-3的激活,以及凋亡细胞的死亡,从而减轻肺部炎症以及组织学改变。Mcclendon等 [16] 研究LPS导致的大鼠急性肺损伤模型也发现,HIF-1
可以通过抑制Fas/FasL、减轻caspase-3的激活,以及凋亡细胞的死亡,从而减轻肺部炎症以及组织学改变。Mcclendon等 [16] 研究LPS导致的大鼠急性肺损伤模型也发现,HIF-1  可以通过增强VEGR、GLUT1、SDF1及其受体CXCR4等靶基因的表达,促进肺泡Ⅱ型上皮细胞的增殖和转移,从而促进肺损伤的修复。
可以通过增强VEGR、GLUT1、SDF1及其受体CXCR4等靶基因的表达,促进肺泡Ⅱ型上皮细胞的增殖和转移,从而促进肺损伤的修复。
尽管危重病人的治疗有所改善,但急性肺损伤的医院病死率仍然高达40%左右 [17] ,可能与临床对ALL/ARDS的治疗主要以病因治疗以及对症支持治疗为主有关。而支持治疗中主要以机械通气为主,强调小潮气量、最佳PEEP等保护性通气机制,长久的辅助通气虽保证了患者的氧合,但呼吸机相关的肺损伤也无可避免,其中呼吸机相关的肺炎也成为患者死亡的重要因素 [18] ,而无法脱机也是影响病人痊愈的另一个重要因素。
另一方面,糖皮质激素作为一个经典的抗炎药,理论上可通过抑制中性粒细胞的活化、抑制成纤维细胞的增殖及胶原的沉积,从而抑制免疫、抑制炎症及后期的纤维化过程,从多个环节阻止疾病的发生发展。Vettorazzi等 [19] 研究表明,地塞米松还可通过糖皮质激素受体(GCS)上调巨噬细胞SPHK1基因的表达,使血液中SPHK1基因的酶促产物S1P水平增高,从而保护内皮屏障功能,减缓疾病进程。但全身大量使用糖皮质激素是否会增加感染等并发症的风险,以及对远期死亡率的干预仍缺乏大样本、多中心的临床研究 [20] 。
截至目前,急性肺损伤仍然是导致急危重病患者死亡的主要原因之一,找到一种新的、有效的治疗方式将会给患者带来极大的生存希望。以往的治疗方法,在治疗病人的同时,往往对其造成损伤或者有较大副作用。鉴于急性肺损伤同时存在炎症和缺氧的病理生理过程,低氧诱导因子稳定表达,因此在急性肺损伤早期,通过抑制HIF途径减少炎症因子、ROS的释放,从而有望减少肺损伤。而在急性肺损伤晚期,增加HIF-1  的表达,从而增强腺苷A2B通路,或者通过增强血管生成、红细胞生成、糖酵解等生理过程,可能会为急性肺损伤患者的治疗提供新的途径,需要大量的临床研究进一步探讨。
的表达,从而增强腺苷A2B通路,或者通过增强血管生成、红细胞生成、糖酵解等生理过程,可能会为急性肺损伤患者的治疗提供新的途径,需要大量的临床研究进一步探讨。
参考文献 :
[1]HYPOXIA D N.HIF1 and glucose metabolism in the solid tumour[J].Nat Rev Cancer,2008,8(9): 705-713.
[2]VOHWINKEL C U,HOEGL S,ELTZSCHIG H K.Hypoxia signaling during acute lung injury[J].J Appl Physiol,2015,119(10): 1157-1163.
[3]WIEST R,LAWSON M,GEUKING M.Pathological bacterial translocation in liver cirrhosis[J].J Hepatol,2014,60(1): 197-209.
[4]CUMMINS E P,BERRA E,COMERFORD K M,et al.Prolyl hydroxylase-1 negatively regulates IkappaB kinase-beta,giving insight into hypoxia-induced NFkappaB activity[J].Proc Natl Acad Sci U S A,2006,103(48): 18154-18159.
[5]SCORTEGAGNA M,CATAISSON C,MARTIN R J,et al.HIF-1alpha regulates epithelial inflammation by cell autonomous NFkappaB activation and paracrine stromal remodeling[J].Blood,2008,111(7): 3343-3354.
[6]SOUZA C O,TEIXEIRA A A,BIONDO L A,et al.Palmitoleic acid reduces the inflammation in LPS-stimulated macrophages by inhibition of NFκB,independently of PPARs[J].Clin Exp Pharmacol Physiol,2017,44(5): 566-575.
[7]PALSSON-MCDERMOTT E M,CURTIS A M,GOEL G,et al.Pyruvate kinase M2 regulates Hif-1α activity and IL-1β induction and is a critical determinant of the warburg effect in LPS-activated macrophages[J].Cell Metab,2015,21(1): 65-80.
[8]SEMENZA G L.Hypoxia-inducible factors: coupling glucose metabolism and redox regulation with induction of the breast cancer stem cell phenotype[J].EMBO J,2017,36(3): 252-259.
[9]MA Z,ZHANG Y,LI Q,et al.Resveratrol improves alcoholic fatty liver disease by down regulating HIF-1α expression and mitochondrial ROS production[J].PLoS One,2017,12(8): e0183426.
[10]SUN H L,PENG M L,LEE S S,et al.Endotoxin-induced acute lung injury in mice is protected by 5,7-dihydroxy-8-methoxyflavone via inhibition of oxidative stress and HIF-1α[J].Environ Toxicol,2016,31(12): 1700-1709.
[11]SEP ![]() LVEDA C,PALOMO I,FUENTES E.Role of adenosine A2b receptoroverexpression in tumor progression[J].Life Sci,2016,166(166): 92-99.
LVEDA C,PALOMO I,FUENTES E.Role of adenosine A2b receptoroverexpression in tumor progression[J].Life Sci,2016,166(166): 92-99.
[12]HART M L,GORZOLLA I C,SCHITTENHELM J A,et al.Hypoxia-inducible factor-1 alpha-dependent protection from intestinal ischemia/reperfusion injury involves ecto-59-Nucleotidase(CD73) and the a2B adenosine receptor[J].Journal of Immunology,2017,199(5): 1942.
[13]THIEL M,CHOUKER A,OHTA A,et al.Oxygenation inhibits the physiological tissue-protecting mechanism and thereby exacerbates acute inflammatory lung injury[J].PLoS Biol,2005,3(6): 1088-1100.
[14]ECKLE T,BRODSKY K,BONNEY M,et al.HIF1A reduces acute lung injury by optimizing carbohydrate metabolism in the alveolar epithelium[J].PLoS Biol,2013,11(9): e1001665.
[15]NAGAMINE Y,TOJO K,YAZAWA T,et al.Inhibition of prolyl hydroxylase attenuates Fas ligand-induced apoptosis and lung injury in mice[J].Am J Respir Cell Mol Biol,2016,55(6): 878-888.
[16]MCCLENDON J,JANSING N L,REDENTE E F,et al.Hypoxia-inducible factor 1alpha signaling promotes repair of the alveolar epithelium after acute lung injury[J].Am J Pathol,2017,Aug 187(8): 1772-1786.
[17]BROWN L M,CALFEE C S,MATTHAY M A,et al.A simple classification model for hospital mortality in patients with acute lung injury managed with lung protective ventilation[J].Crit Care Med,2011,39(12): 2645-2651.
[18]CORRADO R E,LEE D,LUCERO D E,et al.Burden of adult community-acquired,health-care-associated,hospital-acquired,and ventilator-associated pneumonia: New York city,2010 to 2014[J].Chest,2017,152(5): 930-942.
[19]VETTORAZZI S,BODE C,DEJAGER L,et al.Glucocorticoids limit acute lung inflammation in concert with inflammatory stimuli by induction of SphK1[J].Nat Commun,2015,6: 7796.
[20]BANUELOS J,CAO Y,SHIN S C,et al.Granulocyte colony-stimulating factor blockade enables dexamethasone to inhibit lipopolysaccharide-induced murine lung neutrophils[J].PLoS One,2017,12(5): e0177884.
通信作者: 熊彬,xiobin321@163.com
优先数字出版地址: http://kns.cnki.net/kcms/detail/51.1688.R.20180921.1638.050.html
DOI: 10.11851/j.issn.1673-1557.2018.05.027
【文献标识码】 A
【 中图分类号 】 R563.1 + 9
(收稿日期: 2017-11-13)