1982 年Freir首次提出了针对恶性肿瘤治疗的新辅助化疗方案,主要目的在于减小肿瘤体积从而提高R0切除率,消灭隐匿微转移灶,减少术后复发风险,评估肿瘤对化疗药物的敏感性以指导术后化疗[1]。研究表明,新辅助化疗可有效提高进展期胃癌的手术切除率,减低术后复发转移风险,延长患者总生存期[1-4]。本研究以我院经胃镜及影像学确诊的进展期胃癌患者为研究对象,探讨进展期胃癌新辅助化疗的疗效以及围手术期的并发症,为胃癌患者的诊治提供参考依据。
1 资料与方法
1.1 一般资料 选择2013年8月至2016年7月在宁夏医科大学总医院经胃镜及病理检查证实的可切除的进展期胃癌患者,分为治疗组与对照组,每组各50例。治疗组为新辅助化疗+手术组,对照组为单纯手术组,治疗组每纳入1例患者,同期对照组纳入1例病情相似的且拒绝新辅助化疗的可切除进展期胃癌患者。纳入标准:(1)术前均经病理学证实为胃癌患者;(2)按临床分期,术前胃镜、B超、CT等均证实为进展期胃癌;(3)所有病例体力状况评分Karnofsky评分>60分、ECOG评分<2分、白细胞数>4.0×109/L;(4)患者和家属知情同意。排除标准:(1)有严重的心、肺、脑、肝、肾等疾病,存在手术、化疗禁忌者;(2)既往接受过化疗、放疗、介入灌注化疗、免疫治疗等相关抗肿瘤治疗;(3)同时性双原发癌或多原发癌,既往有恶性肿瘤病史,未治愈者,残胃癌;(4)局部侵犯严重、广泛淋巴结转移融合或远处转移,估计无法切除者。
所有患者第一次入院治疗前均告知试验目的及可能出现的相关治疗并发症,均签署知情同意书,该试验得到了宁夏医科大学总医院科研伦理委员会批准。治疗组50例患者中2例患者化疗后拒绝手术,1例患者完成化疗后于外院行手术治疗,排除对应的3例对照组患者,最终对94例患者的数据进行了分析,其中:男71例,女23例;年龄39~77岁,中位数年龄59岁。治疗组47例,其中:男37例,女10例;平均年龄(58.17±8.86)岁。对照组47例,其中:男34例,女13例;平均年龄(60.85±8.60)岁。2组患者年龄、性别、民族、BMI值、吸烟史、饮酒史、组织分化程度及治疗前临床分期均无显著性差异(P>0.05),具可比性。
1.2 化疗方法 化疗方案包括EOF化疗方案(表柔比星+奥沙利铂+亚叶酸钙+氟尿嘧啶)、SOX化疗方案(奥沙利铂+替吉奥)、FOLFOX化疗方案(奥沙利铂+5-FU+亚叶酸钙)、ECF化疗方案(表柔比星+顺铂+氟尿嘧啶+亚叶酸钙)。治疗组术前给予规范的新辅助化疗,化疗2个周期内即可通过影像学评估疗效,以决定继续化疗还是提前终止。
1.3 疗效观察指标 疗效评价参照WHO实体瘤疗效评价标准分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),化疗有效率(RR)为(CR+PR)/总例数,疾病控制率(DCR)为(CR+PR+SD)/总例数。TNM分期按国际抗癌联盟(UICC)和美国癌症联合会(AJCC)联合制定的第7版《癌症分期手册》进行分期[5]。
1.4 手术方法 治疗组(新辅助化疗后)、对照组胃癌患者术前评估,排除手术禁忌证后行手术治疗。根据具体情况行胃癌根治术、姑息性切除术、开关术。
1.5 统计学处理 采用SPSS17.0统计软件对各项指标进行统计学分析。计量资料的比较采用t检验,计数资料的比较采用χ2检验、Fisher确切概率检验以及秩和检验。
2 结 果
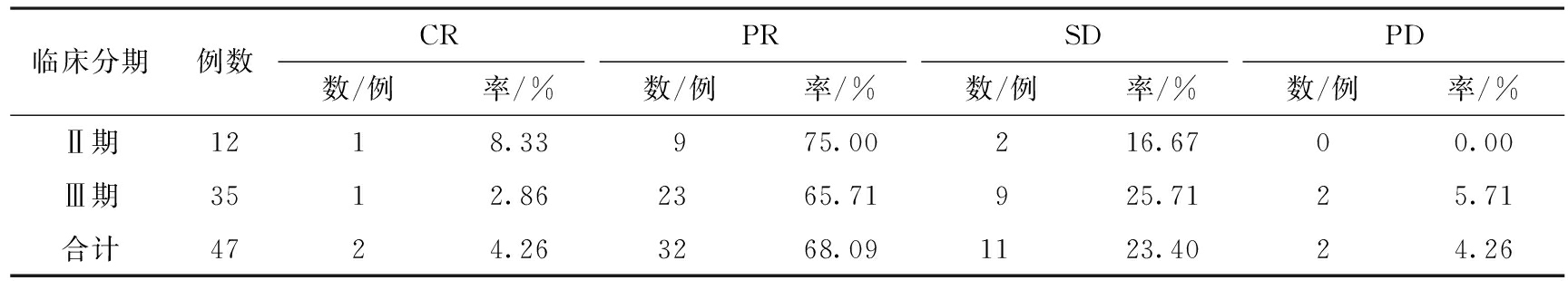
2.1 治疗组新辅助化疗的疗效 治疗组均完成2~4周期化疗,其中CR 2例,PR 32例,SD 11例,PD 2例,RR为72.34%,DCR为95.74%。治疗组47例患者中化疗前Ⅱ期12例,Ⅲ期35例,化疗后Ⅰ期3例,Ⅱ期22例,Ⅲ期20例,Ⅳ期2例,化疗前Ⅱ期患者占25.53%,化疗后Ⅱ期患者达46.81%,化疗前后分期的比较有显著性差异(P<0.05)。新辅助化疗前17例患者的肿瘤标识物CEA异常升高、19例患者的肿瘤标识物CA199异常升高,新辅助化疗后CEA异常升高者减少了5例,CA199异常升高者减少了5例,新辅助化疗降低了CEA、CA199 的表达(P<0.05)。结果详见表1。
表1治疗组新辅助化疗疗效比较
2.2 2组围手术期指标及手术切除率比较 治疗组手术时间长于对照组(P<0.05)。治疗组术中出血量多于对照组(P<0.05)。对照组术后住院时间较治疗组短(P<0.05)。清扫淋巴结个数及术后并发症,2组比较均无显著性差异(P>0.05)。治疗组的手术根治率显著性高于对照组(P<0.05)。结果详见表2。
表2 2组围手术期指标及手术切除率比较

注:1)与对照组比较P<0.05
3 讨 论
胃癌发病率高,预后差,因其起病隐匿,且症状缺乏特异性,多数患者就诊时已是进展期。进展期胃癌通常原发病灶较大,与胃周脏器黏连甚至浸润固定,或广泛浸润转移失去根治性切除的机会,或仅能进行姑息性手术,而术后容易复发及转移,术后复发和转移的发生率高达50%~70%[5]。进展期胃癌一般单纯手术治疗后复发与转移概率高,因此应用单纯手术治疗较难提高进展期胃癌的生存时间。自1989年Wilke等[6]首次应用新辅助化疗于胃癌患者,大量临床试验相继报道该疗法。英国医学研究委员会主持的MAGIC研究首次将新辅助化疗联合辅助化疗的综合治疗用于进展期胃癌[7],与对照组比较,治疗组的5年生存率明显提高,复发转移率、病死率明显降低,成为胃癌新辅助化疗研究发展的一个重要里程碑。美国的NCCN也已经将新辅助化疗作为A类推荐列入胃癌临床实践指南之中。
本研究结果显示,化疗2~4 个周期后治疗组患者总有效率达95.74%。新辅助化疗取得良好的效果,胃癌患者手术之前接受新辅助化疗可以缩小肿瘤体积、控制杀灭微小癌灶、降低TNM分期,与相关研究的结论一致[8-9]。治疗中新辅助化疗前Ⅲ期患者占到74.47%,对照组为61.70%,但治疗中新辅助化疗前Ⅲ期患者略高,这可能与该研究入组患者较少有关。治疗组和对照组均接受了规范的手术治疗,治疗组95.74%患者接受根治性手术,对照组82.98%患者接受根治性手术。治疗组R0切除率明显优于对照组,本研究提示新辅助+手术治疗方案能够提高进展期胃癌患者的手术切除率和R0切除率。治疗组进展期胃癌患者给予新辅助化疗后的DCR明显提高,肿瘤标识物下降,为D2根治术创造了条件,增加了手术R0切除率,与相关研究的结论一致。与此同时,治疗组患者的围手术期并发症的发生率无显著性差异(P>0.05),但手术时间、手术出血量、术后住院时间等方面有显著性差异(P<0.05),分析原因认为部分患者经化疗后,肿瘤细胞坏死瘢痕形成,部分胃周小血管迂曲、增粗,组织容易渗血;新辅助化疗药物对患者机体造成了一定程度的损害,导致机体恢复能力较对照组差,从而住院时间有所增加,但并未增加术后并发症的发生率;除了上述原因,治疗组分期偏晚,可能对手术时间、手术出血量、术后住院时间产生一定影响,有待严格入组标准的前瞻性研究进一步明确。
综上所述,我们认为给予进展期胃癌患者新辅助化疗能够缩小肿瘤体积、降低临床分期、提高R0切除率,并不会增加术后并发症的发生率。本研究病例数少,缺乏新辅助化疗联合手术治疗后生存率影响的研究,有待进行大型随机对照研究进一步证实。
参考文献:
[1]YCHOU M, BOIGE V, PIGNON J P, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase Ⅲtrial[J]. Journal of Clinical Oncology, 2011, 29(13): 1715-1721.
[2]范成美,葛成华.FOLFOX方案在进展期胃癌新辅助化疗中的应用[J].中华临床医师杂志:电子版,2011,5(5):1484-1486.
[3]孙震,李雁.新辅助化疗治疗进展期胃癌疗效的Meta分析[J].武汉大学学报:医学版,2015,36(3):393-398.
[4]熊兵红,马利,罗华友,等.进展期胃癌新辅助化疗疗效评价:16个随机试验的荟萃分析[J].中国肿瘤,2016,25(7):559-568.
[5]李军宏.胃癌根治术后复发临床特点及再次手术治疗的效果分析[D].长春:吉林大学,2014.
[6]WILKE H, PREUSSER P, FINK U, et al. Preoperative chemotherapy in locally advanced and nonresectable gastric cancer: a phase Ⅱ study with etoposide, doxorubicin, and cisplatin[J]. J Clin Oncol, 1989, 7(9): 1318-1326.
[7]CUNNINGHAM D, ALLUM W H, STENNING S P, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. N Engl J Med, 2006, 355(1): 11-20.
[8]韩毓,曲兴龙,柴宇啸,等.多西他赛联合替吉奥新辅助化疗治疗进展期胃癌的疗效和安全性[J].肿瘤,2013(8):734-738.
[9]季加孚,季鑫.胃癌新辅助化疗的现状与展望[J].中国肿瘤临床,2012(20):1458-1461.