口服华法林与骨质疏松性骨折的关联性研究
董 锐1,项 征1,周家砚2
(1.滁州市第一人民医院 骨科,安徽 滁州 239000;2.皖南医学院第二附属医院 心内科,安徽 芜湖 231000)
【摘要】目的:确定口服华法林与骨质疏松性骨折发生是否有关。方法回顾性分析2004年3月至2015年3月收治的口服华法林患者1519例临床资料,选取基线情况适合患者4704例作为对照组,分别计算口服华法林1年、2年、3年、4年、5年及以上患者发生骨质疏松性骨折的风险优势比(OR)。结果口服华法林组整体骨质疏松性骨折及髋部骨折发生率均较对照组显著升高(P<0.05),而口服华法林5年以上的骨质疏松性骨折发生率极显著升高(P<0.01)。结论长期使用华法林将使骨折风险度增高,这种效应在髋部骨折中表现尤为明显。
【关键词】华法林;骨质疏松性骨折;骨密度;髋部骨折
随着老龄化社会的到来,临床上华法林的需求越来越大,这也产生了新的风险。华法林是维生素K拮抗剂(VKAs),一种香豆素衍生物抗凝剂,通过干扰维生素K羧基化循环阻断伽玛羧基谷氨酸(GLA)的生成,从而起到抗凝作用[1],在临床上用于可能威胁到生命的血管栓塞性疾病。接受华法林治疗的患者大多数为老年患者,为使体内国际标准化比值 (international normalized ratio,INR)维持在治疗学水平,患者必须长期定量服药,导致临床上使用抗凝剂产生了新的风险,比如骨质疏松性骨折。维生素K是骨细胞和血管壁维持正常新陈代谢水平的必备成分之一[2],华法林作为维生素K的拮抗剂对骨细胞新陈代谢有没有影响,口服华法林是否会导致骨质疏松性骨折风险升高,目前尚存争议[3]。为此,我们设计这项回顾性队列研究,通过对档案室病例资料的数据分析,验证长期口服华法林对骨质疏松性骨折发生率是否有影响,以便指导临床用药。
1 资料与方法
1.1 纳入及排除标准 纳入标准:女性50岁以上,男性55岁以上,使用华法林1年以上,入院前3周内发生的脆性骨折,摄片提示骨密度低下[4]。排除标准:(1)入院前已经使用抗骨质疏松药物患者;(2)再次发生骨折患者,不做重复统计;(3)药物剂量、使用时间等信息不完善患者;(4)偏瘫,帕金森病,肢体活动障碍,糖化血红蛋白(HbA1c)>8.0%;(5)病理性骨折,高能量创伤,假体周围性骨折,脊柱椎体成形术后椎体再骨折。
1.2 一般资料 选择2004年3月至2015年3月滁州市第一人民医院和皖南医学院第二附属医院骨科和心内科的住院患者,采集接受髋膝关节置换手术,治疗房颤、冠心病、动脉粥样硬化的患者临床资料,将口服华法林患者列为研究组,并以基线情况适合的同期住院患者作为对照组,进行回顾性队列研究。按照纳入和排除标准,共有6223例患者纳入研究,合格患者根据区组随机原则,入选华法林组1519例,入选对照组4704例。骨折类型为:髋部骨折,腰椎和胸椎压缩性骨折,腕部骨折,肱骨近端骨折;男2022例,女4211例;年龄50~96岁,平均(68.2±1.5)岁;汉族6205例,少数民族18例;平均口服时间2.3年。2组患者在性别、年龄、代谢情况(肝肾功能)、正常饮食、日常活动(日行走>1 km)、城乡居民等方面无显著性差异(P>0.05),具有可比性。在采集信息过程中,患者个人信息被严格保护,并经过医院道德伦理委员会同意。
1.3 研究步骤及方法 对口服华法林导致骨质疏松性骨折提出假设→设计研究类型为成组设计→选择暴露频率一致的人群作为对照组→用纳入和排除标准选择研究对象→统计样本含量→制定调查表→通过查阅病案电话随访收集资料→第二作者控制调查数据的质量→建立数据库进行统计分析→书写研究报告。分别计算口服华法林1年、2年、3年、4年、5年及以上患者发生骨质疏松性骨折的风险优势比(OR)。
1.4 统计学方法 采用SPSS 18.0统计学软件对数据进行统计学分析。计量资料的比较采用成组设计资料t检验; 计数资料的比较采用χ2检验;采用条件Logistic回归分析评估混杂因素(基础疾病、使用其他药物等),并计算优势比OR和95%CI。
2 结 果
2.1 2组患者使用其他药物以及基础疾病的比较 结果详见表1。
表1 2组使用其他药物以及基础疾病的比较
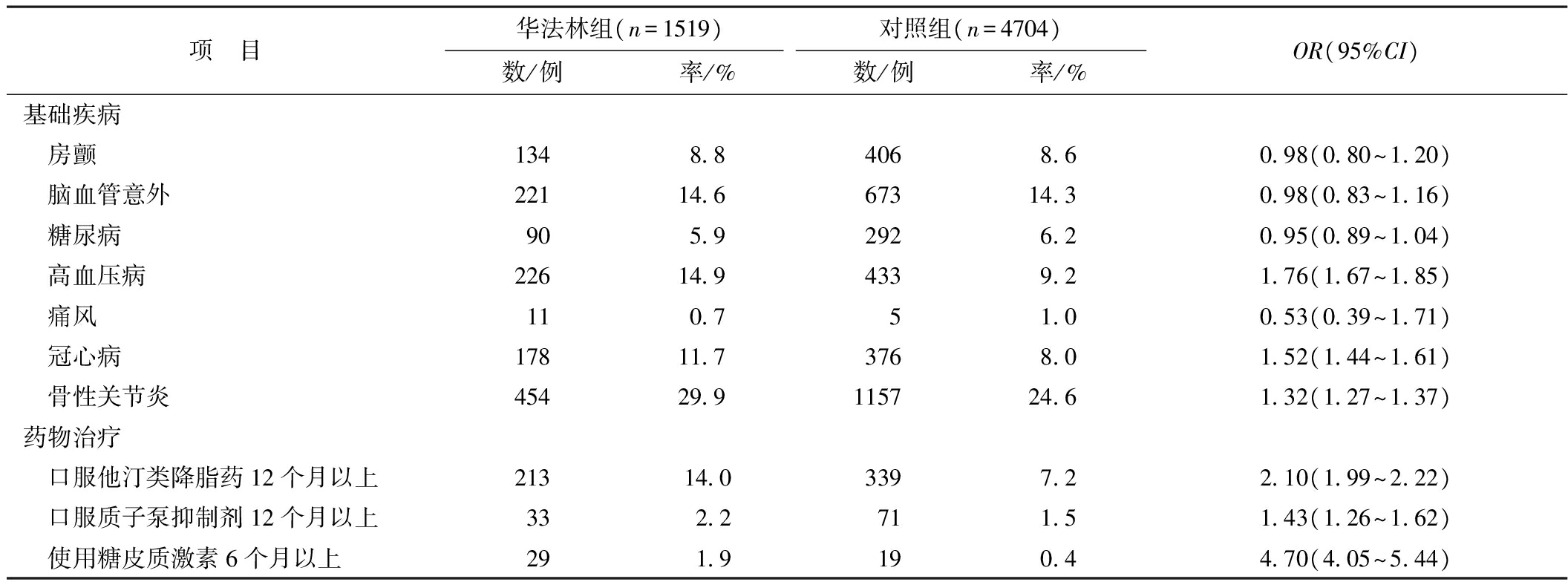
项 目华法林组(n=1519)对照组(n=4704)数/例率/%数/例率/%OR(95%CI)基础疾病 房颤1348840686098(080~120) 脑血管意外221146673143098(083~116) 糖尿病905929262095(089~104) 高血压病22614943392176(167~185) 痛风1107510053(039~171) 冠心病17811737680152(144~161) 骨性关节炎4542991157246132(127~137)药物治疗 口服他汀类降脂药12个月以上21314033972210(199~222) 口服质子泵抑制剂12个月以上33227115143(126~162) 使用糖皮质激素6个月以上29191904470(405~544)
口服华法林组患者在使用糖皮质激素、口服他汀类降血脂药物方面较对照组患者发生率更高;口服华法林组患者在高血压病、冠心病、骨性关节炎、口服质子泵抑制剂(12个月以上)这4个方面与对照组发生率相似,在房颤、脑血管意外、糖尿病、痛风的发生率上2组差异无统计学意义,2组具有均衡性。
2.2 口服华法林对整体骨质疏松性骨折及髋部骨折发生率的影响 结果详见表2。
表2口服华法林对整体骨质疏松性骨折及髋部骨折发生率的影响
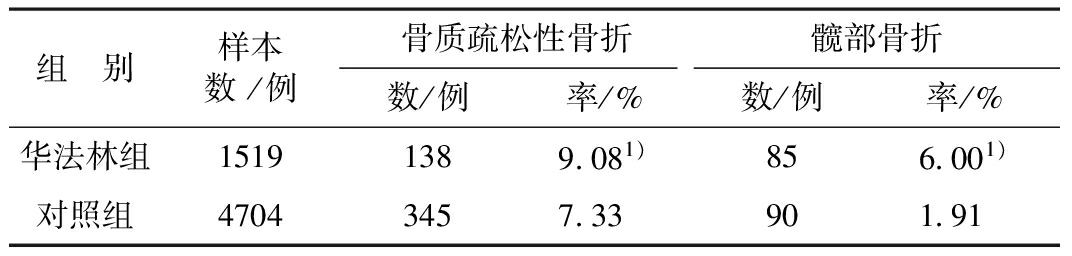
组 别样本数/例骨质疏松性骨折髋部骨折数/例率/%数/例率/%华法林组15191389081)856001)对照组470434573390191
注:1)与对照组比较P<0.05
口服华法林组整体骨质疏松性骨折发生率较对照组升高(校正OR1.26,95%CI1.03~1.56,χ2=4.916,P<0.05),总体髋部骨折发生率亦较对照组升高 (OR0.78,95%CI0.61~0.99,χ2=4.068,P<0.05)。并且,口服华法林5年以上骨质疏松性骨折发生率为11.68%(41/351),显著高于对照组的6.37%(77/1208)(OR1.94,95%CI1.30~2.90,χ2=10.948,P<0.01)。通过对华法林暴露时间与骨质疏松性骨折发生率的关系分析显示,华法林暴露时间与骨质疏松性骨折发生率呈明显的正相关趋势。
3 讨 论
随着我国进入老年社会,老年骨质疏松性骨折发病率呈递增趋势。骨质疏松症的流行病学是髋部、椎体、腕部、肱骨近端骨折的主要危险因素。由于华法林抑制骨钙素的羧化,使用华法林将会减少骨量,加速骨质流失,增加骨折的风险[5]。
Sugiyama等[6]在测量桡骨远端、腰椎、股骨颈和股骨转子间的骨密度后,发现使用华法林与骨密度降低有显著性相关。动物实验同样表明华法林对骨密度的影响[7],大鼠暴露于华法林6周后,股骨和椎体的骨含量显著降低,骨小梁分离,成骨细胞活性和骨吸收参数下降。本研究虽未在股骨转子间检查骨密度,但髋部骨折发生率的升高间接表明髋骨骨密度的降低。
维生素K在人体骨新陈代谢过程中扮演着重要的角色[8]。鲑鱼降钙素是一种含羧基谷氨酸蛋白,在分泌至血清中之前被合成转化为成骨细胞。羟化的鲑鱼降钙素在骨质形成的过程中起着至关重要的作用,它能够促进钙离子黏附到骨基质上的羟基磷灰石中,从而加强骨质的力学强度,在黏附过程中人体内必须有多余的伽玛羧基谷氨酸。因为华法林是通过抑制维生素K的羟化起到抗凝作用的,所以华法林也可抑制鲑鱼降钙素的羟化,虽然临床上还未明确证实抑制鲑鱼降钙素羟化对骨质疏松症发生率有影响[9],但是,体外实验已有明确证据表明[10-11],华法林能显著抑制人成骨细胞的细胞外基质骨钙素的沉积。在凝血连锁反应中,谷氨酸羟基化转化为凝血因子(Ⅱ、Ⅶ、Ⅸ、Ⅹ)、凝血蛋白C及凝血蛋白S,而维生素K则是该化学反应所必需的辅酶因子,通过抑制维生素K,凝血途径也受到抑制。华法林是羟基化酶抑制剂,它能够有效抑制肝脏微粒体内的羟基化酶,从而抑制肝脏微粒体内的凝血因子羟化反应,未羟化的凝血因子没有凝血活性,而已羟化的凝血因子华法林对其没有抑制作用[12]。
迄今为止,华法林已经成为治疗房颤、预防中风最成功的口服药物之一,但是华法林治疗量区间很窄,需要定期频繁地检测INR,并不断调整剂量[13-15],长期使用华法林也成为患者被迫的选择。体内长时间的华法林累积,对凝血循环过程中蛋白酶生物转化的影响是不容置疑的。人体内有3种维生素K依赖型蛋白:鲑鱼降钙素(OC)、γ谷氨酸基质蛋白(MGP)、生长抑制特异性蛋白6 (Gas-6)[16-17],这3种蛋白分别有维持骨质强度、控制动脉钙化、调节细胞增生的作用,并且这些蛋白及其基质都有使谷氨酸残基激活被γ羟基化的作用;不被γ羟基化或者γ羟基化不完全的谷氨酸残基被称为ucOC,这种化合物使成骨细胞的生成和释放都减少。因此,长期使用华法林与骨质疏松性骨折有关联,体内低维生素K水平将导致骨密度降低。
综上所述,使用华法林将导致整体骨质疏松性骨折及髋部骨折发生率升高,且长时间(>5年)使用华法林会导致脆性骨折发生率明显升高。但本研究是回顾性研究而非前瞻性研究,未测量患者骨密度,这是不足之处,将在今后进一步加以探讨。
参考文献:
[1]NAMBA S, YAMAOKA-TOJO M, HASHIKATA T, et al. Long-term warfarin therapy and biomarkers for osteoporosis and atherosclerosis[J]. BBA clinical, 2015, 4(4): 76-80.
[2]FALCK-YTTER Y, FRANCIS C W, JOHANSON N A, et al. Prevention of VTE in orthopedic surgery patients: antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(Suppl 2): e278S-e325S.
[3]AMIZUKA N, LI M, HARA K, et al. Warfarin administration disrupts the assembly of mineralized nodules in the osteoid[J]. J Electron Microsc (Tokyo), 2009, 58(2): 55-65.
[4]NONGMAITHEM R S, PERTIN M, CHIRU C, et al. Bone mineral density profile among post-menopausal women in Manipur: a hospital-based study[Z], 2016.
[5]REZAIEYAZDI Z, FALSOLEIMAN H, KHAJEHDALUEE M, et al. Reduced bone density in patients on long-term warfarin[J]. Int J Rheum Dis, 2009, 12(2): 130-135.
[6]SUGIYAMA T, KUGIMIYA F, KONO S, et al. Warfarin use and fracture risk: an evidence-based mechanistic insight[J]. Osteoporos Int, 2015, 26(3): 1231-1232.
[7]FUSARO M, DALLE CARBONARE L, DUSSO A, et al. Differential effects of dabigatran and warfarin on bone volume and structure in rats with normal renal function[J]. PLoS One, 2015, 10(8): e0133847.
[8]RUFF C T, GIUGLIANO R P, BRAUNWALD E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials[J]. Lancet, 2014, 383(9921): 955-962.
[9]TUFANO A, COPPOLA A, CONTALDI P, et al. Oral anticoagulant drugs and the risk of osteoporosis: new anticoagulants better than old?[J] Semin Thromb Hemost, 2015,41(4):382.
[10]HAMED S A, MOUSSA E M, YOUSSEF A H, et al. Bone status in patients with epilepsy: relationship to markers of bone remodeling[J]. Front Neurol,2014,5:142.
[11]KRÜGER T, OELENBERG S, KAESLER N, et al.Warfarin induces cardiovascular damage in mice[J]. Arterioscler Thromb Vasc Biol, 2013, 33(11): 2618-2624.
[12]AYNARDI M, BROWN P B, POST Z, et al. Warfarin for thromboprophylaxis following total joint arthroplasty: are patients safely anti-coagulated?[J]. J Arthroplasty, 2013, 28(8): 1251-1253.
[13]MAC-WAY F, POULIN A, UTESCU M S, et al. The impact of warfarin on the rate of progression of aortic stiffness in hemodialysis patients: a longitudinal study[J]. Nephrol Dial Transplant, 2014, 29: 2113-2120.
[14]JEONG H M, CHO D H, JIN Y H, et al. Inhibition of osteoblastic differentiation by warfarin and 18-α-glycyrrhetinic acid[J]. Arch Pharm Res, 2011, 34(8): 1381-1387.
[15]KASUKAWA Y, MIYAKOSHI N, EBINA T, et al. Effects of risedronate alone or combined with vitamin K2on serum undercarboxylated osteocalcin and osteocalcin levels in postmenopausal osteoporosis[J]. J Bone Miner Metab, 2014, 32(3): 290-297.
[16]STENOVA E, STENO B, KILLINGER Z, et al. Effect of long-term oral anticoagulant therapy on bone mineral density and bone turnover markers: a prospective 12 month study[J].Bratisl Lek Listy, 2011, 112(2): 71-76.
[17]SATO Y, HONDA Y,JUN I. Long-term oral anticoagulation therapy and the risk of hip fracture in patients with previous hemispheric infarction and nonrheumatic atrial fibrillation[J]. Cerebrovasc Dis, 2010, 29(1): 73-78.
Associationbetweenoraladministrationofwarfarinandosteoporoticfracture
DONG Rui1, XIANG Zheng1, ZHOU Jiayan2
(1.Department of Orthopedics, First People’s Hospital of Chuzhou, Chuzhou, Anhui 239000, China; 2.Department of Cardiology, Second Affiliated Hospital of Wannan Medical College,Wuhu, Anhui 231000,China)
【Abstract】Objective: To determine the association between oral administration of warfarin and the occurrence of osteoporotic fracture.MethodsThe clinical data of 1519 patients receiving oral administration of warfarin was retrospectively analyzed from March 2004 to March 2015. 4704 patients with matched baseline status were selected as control group. Odds ratios (OR) of osteoporotic fracture risk were calculated after 1-,2-,3-,4-,5-year and above 5-year oral administration of warfarin.ResultsThe incidences of overall osteoporotic fracture and hip fracture in oral warfarin group were significantly higher than those in the control group of (P<0.05), and the incidence of osteoporotic fracture in patients orally given warfarin more than 5 years increased very significantly (P<0.01).ConclusionLong-term use of warfarin may increase the risk of fracture, particularly in hip fracture.
【Keywords】warfarin; osteoporotic fracture; bone mineral density; hip fracture
通信作者:董锐,dongruird@163.com
【中图分类号】R973.2;R681
【文献标识码】A
DOI:10.11851/j.issn.1673-1557.2017.06.008
优先数字出版地址:http://kns.cnki.net/kcms/detail/51.1688.R.20171121.1631.050.html
(收稿日期:2016-12-14)

