 RINEN J, HASSINEN I E, SORMUNEN R, et al. Hearts of hypoxia-inducible factor prolyl 4-hydroxylase-2 hypomorphic mice show protection against acute ischemia-reperfusion injury[J]. J Biol Chem, 2010, 285(18): 13646-13657.
RINEN J, HASSINEN I E, SORMUNEN R, et al. Hearts of hypoxia-inducible factor prolyl 4-hydroxylase-2 hypomorphic mice show protection against acute ischemia-reperfusion injury[J]. J Biol Chem, 2010, 285(18): 13646-13657.宋小莉,苏 娟
(青海大学附属医院,青海 西宁 810001)
【摘要】在氧气受限的情况下,脯氨酸羟化酶(PHD)的活性受到抑制,通过各种机理调节细胞内的氧适应水平,参与多种疾病的发生、发展。本文对PHD的各种调节机理及信号通路作一综述,以期为PHD相关疾病的治疗提供新的治疗思路及靶点。
【关键词】缺氧;脯氨酸羟化酶;调节机理
脯氨酸羟化酶(prolyl hydroxylase,PHD)是缺氧诱导因子(hypoxia inducible factor,HIF)通路的重要调节因子之一。在氧气受限的情况下,PHD的活性受到抑制,通过各种机理调节细胞内的氧适应水平,包括mTOR通路、NF-κB通路、细胞凋亡和细胞代谢等, 从而参与多种疾病的发生、发展。本文总结近年来PHD的各种调节机理及信号通路,以期通过研究复杂的机理为PHD相关疾病的治疗提供新的治疗思路及靶点。
PHD是一类依赖氧、α-酮戊二酸和Fe2+催化的非血红素、铁依赖性加双氧酶。目前发现主要有4种,即PHD1、PHD2、PHD3 和PHD4。但关注热点主要是前3种,PHD1在细胞核中广泛表达,PHD2主要在细胞质表达,PHD3则在细胞核与细胞质中均有表达。PHD1又名HPH3(HIF-prolyl-hydroxylase 3)和EGLN2(egg-laying deficient nine-like protein 2 ),PHD2又名HPH2和EGLN1,PHD3又名HPH1和EGLN3[1],3种亚基的结构既相似又有不同,其在C端的序列高度同源,但PHD2在N端独有的锌指结构是PHD1和PHD3不具备的。另外,PHD1、PHD2可以羟基化HIF-1α pro402而PHD3却不可以。PHD1 mRNA可以表达于多种组织,其中以胎盘及睾丸组织中最多。而目前PHD2 mRNA研究最多,在许多组织中均存在,PHD3较PHD1及PHD2表达较少,主要在心脏及胎盘中表达[2]。PHD家族成员目前已在多种疾病中扮演重要角色,如炎症、肿瘤、造血、心肌保护、代谢性疾病、骨修复和骨再生[3-6]。
HIF蛋白稳定性与活性受到严密调节,HIF-α的羟基化是VHL肿瘤抑制蛋白(von-Hippel-Lindau tumor suppressor protein,pVHL)与其结合的必要条件。HIF-α脯氨酰残基羟基化是其降解的关键,而催化此过程的PHD便是全程限速酶。调节PHD活性的因素包括氧压、作为共同亚基的α-KG、铁离子、抗坏血酸等。
2.1 氧压 PHD作为加双氧酶家族的一员,O2的Km值为100 μm,与其他加双氧酶相比,其值明显升高,这就意味着O2对PHD的活性调节至关重要且不能被H2O取代,也是PHD可以作为氧感受器的依据。研究发现,PHD2和PHD3的mRNA表达水平在缺氧比常氧条件下高出10~20倍[7]。PHD通过E3泛素酶Siah1和Siah2调节O2的活性,在缺氧的条件下,Siah2转录活性被激活,导致PHD1和PHD3下降[8]。缺氧可以导致反应性氧应答(reactive oxygen species,ROS),在线粒体转运链产生复合体Ⅲ,ROS通过调节Fe2+、抗坏血酸、三羧酸的水平来抑制PHD的活性[9]。另外,研究表明[10],在缺氧条件下NO可以抑制ROS的产生,使得细胞内的O2重新分布,影响PHD的活性。Lee等[11]指出,氧化应激可通过二硫键的形成诱导PHD2发生二聚化作用,使PHD2活性增加,激活下游靶基因,如血管内皮因子、葡萄糖转运蛋白等,参与血管新生及细胞代谢。还指出ROS抑制PHD2的活性,从而参与糖代谢,但具体机理未阐述。
2.2 α-KG α-KG是三羧酸循环的媒介物,α-KG可被谷氨酰胺酶和谷氨酸脱氢酶催化,这些酶激活2个组氨酸残基和1个天冬氨酸残基来协调Fe2+在活区域的活性,导致底物的电子氧化,激活PHD下游基因[12]。PHD大多数产生于线粒体,并通过酮戊二酸-苹果酸转运体使得α-KG由线粒体转运到细胞质。α-KG不可代谢的类似物如甲基乙二酰基甘氨酸(dimethyloxalglycine,DMOG),可竞争性抑制PHD的活性及稳定HIF-1α的活性[13]。另外,TCA中的关键酶,如柠檬酸盐、异柠檬酸盐、延胡索酸、苹果酸盐、草酰乙酸、丙酮酸盐也被报道可以抑制PHD。延胡索酸、琥珀酸盐、草酰乙酸可通过IC50竞争性抑制PHD的3个亚基,其中抑制作用最强的是延胡索酸,最弱的是草酰乙酸。且柠檬酸盐可以有效抑制PHD3,但不能抑制PHD1和PHD2。琥珀酸盐脱氢酶和延胡索酸水化酶缺乏导致细胞质中氨基酸的聚集,也可抑制PHD的活性。另外,外源性的α-KG或者延胡索酸的积累,可以再激活PHD并使HIF-1α失去稳定[14]。α-KG的水平依靠氨基酸的利用,在氨基酸缺乏的条件下,α-KG减少,PHD活性减低。
2.3 铁 PHD属于非血红素、铁依赖性酶家族。铁反应物在活性区域依靠铁螯合物和RNA结合蛋白活性的PCBP家族,通过稳定HIF-α转运活性,铁的螯合物或者铁对抗剂可以抑制PHD的活性。结构和光谱学研究表明,活性区域Fe2+可以代替Co、Cu、Zn、Mn和钴直接结合HIF-α并且阻止其下降[15]。Miles等[16]指出,通过抑制或者破坏V-ATP酶,使PHD活性受到抑制,可导致细胞内铁的缺乏,转铁蛋白的摄取和铁转运减少。Rajagopalan等[17]指出,在帕金森病中,抑制PHD可导致黑质中铁水平的增加、线粒体功能障碍、神经元减少,原因可能与ATP13A2基因突变有关,减少线粒体中酶的活性,神经基底核铁的活性可能会提高ATP13A2基因的突变。在树突状细胞中,脂多糖诱导的炎症通过NF-κB抑制PHD活性,使细胞内可用铁减少,导致HIF-α稳定性下降并激活免疫系统[14]。并且,Huang等[15]研究发现,在网织红细胞的裂解产物中铁含量越少,PHD的活性就越大。因此,铁代谢和HIF、PHD之间存在着复杂交联,但具体机理仍值得研究。
2.4 抗坏血酸 抗坏血酸作为PHD重要调节因素,在脱羧反应中提供可选择性的氧受体。有专家提出,在活性区域,抗坏血酸可以减少Fe3+向Fe2+转换。有研究表明,抗坏血酸在黑色素瘤的发生及扩增中有重要意义[18]。该研究通过剔除PHD来增加HIF-1的活性,发现可以通过增加抗坏血酸来减少HIF-1的积累,可能减少黑色素瘤癌细胞的扩增。另外,缺少抗坏血酸可以增加骨折的风险,减少骨量的形成。Xing等[19]研究表明,通过在慢性病毒抑制PHD2的表达,抑制抗坏血酸诱导的成骨细胞相关转录因子抗体,可以导致小鼠的骨量减少。但抗坏血酸在人类中导致骨量减少的具体机理,目前尚未见明确报道。
PHD已被证实可通过依赖HIF通路来控制代谢、细胞转运、基因表达和细胞凋亡。
3.1 调节细胞代谢 在HIF通路中,PHD控制糖酵解关键酶的羟基化,包括丙酮酸激酶(pyruvate kinase, PK)和丙酮酸脱氢酶(pyruvate dehydrogenase,PDH),通过增加丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase 1,PDK1)和减少PDH的活性,抑制PDK1和剔除HIF-1α的活性,使得骨髓巨噬细胞中PHD2的活性增加[20]。研究指出,缺乏PHD1基因的小鼠,其骨骼肌细胞中的葡萄糖氧化磷酸化下降,而糖酵解活性增加,最终造成缺乏PHD1基因小鼠运动能力减退[21]。Yang等[22]证实,在剔除HIF-1α的类风湿关节炎患者中,成纤维样滑膜细胞中的葡萄糖减少,而乳酸脱氢酶增加,加剧糖酵解。业已证实,被PHD2催化的羟基化反应主要依靠α-KG作为共同作用子,且PHD2的活性可被三羧酸循环抑制[23]。PHD3可增加M2型丙酮酸激酶(PKM2)和HIF-1α的联系,激活多个结构域,包括HIF-1α的反式激活结构域和PAS结构域,PKM2激活HIF的靶基因,在癌细胞中使得糖酵解增多[24]。所以,PHD在HIF依赖及非HIF依赖的方式中可能是通过调节PKM2和PDH的活性来控制糖酵解的速率。
3.2 调节线粒体的生理学功能 PHD在能量代谢等多个方面均有参与。PHD的抑制剂DMOG通过抑制PHD,激活HIF-1和NF-κB通路,参与炎症的发生、发展。有报道指出,PHD可在肠炎及腹泻中扮演保护作用[25]。另外,在心肌细胞及结肠癌细胞中,DMOG或可抑制线粒体功能,激活糖酵解途径,从而在PHD/HIF通路中抑制呼吸链的活性,来减少ATP积累,减少组蛋白H4赖氨酸16乙酰化的作用,起到保护细胞作用[26]。因此,PHD的研究或可为心肌缺血疾病及肠道疾病的治疗方面提供新的思路。
3.3 调节神经元的新陈代谢 Quaegebeur等[27]指出,PHD1缺乏在缺血性脑病中可保护神经元。在大鼠缺血模型中,PHD-神经细胞诱导葡萄糖代谢的重组,而不涉及血管的改变。葡萄糖转换为磷酸戊糖途径代替糖酵解途径,有助于清除氧自由基和保护神经元不死亡。PHD1的缺乏可以减少羟基化,增加NF-κB受体的活性,在神经元的代谢中成为一个调节受体,PHD1在缺血性脑病中或可作为一个潜在的治疗目标。而Marti等[28]指出,在神经元中,PHD2的失活可以导致HIF稳定性增加和激活VEGF的活性,有助于神经元的再恢复,还导致HIF依赖的葡萄糖转运体及糖酵解酶的增加,从而增加缺血的耐受性,减少线粒体活性氧的产生,起到一定的保护神经元作用。
4.1 雷帕霉素靶蛋白(mTOR)信号通路 PHD通过氨基酸途径参与哺乳动物mTOR信号通路。mTOR有两个受体:mTORC1和mTORC2,因为雷帕霉素特异性抑制mTORC1,所以前者的研究较后者多[29]。氨基酸通过Rheb GTP使得mTORC1转运到溶酶体表面,并在溶酶体表面形成异质二聚体。Rag家族有4个,RagA/RagB/RagC/RagD,其两两成为异二聚体,在RagA/RagB中,氨基酸诱导GDP向GTP转换,允许Rag异二聚体与mTORC1结合,激活下游信号通路[30]。通过谷氨酰胺的分解,谷氨酸盐产生α-KG,α-KG是mTORC1所必需的激活物,抑制PHD促使谷氨酰胺分解从而激活mTORC1,然而,具体机理尚不明确。
4.2 NF-κB信号通路 NF-κB参与炎症及自身免疫的应答。研究表明,PHD1或者FIH基因沉默后可以诱导LI-1β介导的NF-κB的活性[31]。在肺癌A547细胞和HEK293 T细胞中,PHD1通过过度表达及RNA干扰,抑制NF-κB的活性及其下游靶基因,从而抑制肿瘤细胞的扩增。PHD2通过上调NF-κB信号通路控制TNF-α的表达,沉默PHD2可以显著减少TNF-α诱导的代谢信号,如多配体蛋白聚糖-4(syndecan 4,SDC4)、金属蛋白酶-3(matrix metalloproteinase 3,MMP-3)、MMP-13及其他炎症因子及细胞因子[32]。
4.3 内皮细胞生长因子受体信号 Matsuura等[33]研究发现,通过RNA干扰抑制PHD2的活性可以导致血管紧张素Ⅱ表达下降,从而为治疗心脑血管疾病提供新的治疗思路。Kapitsinou等[34]在小鼠实验研究中表明,使小鼠脉管系统的内皮细胞PHD2的失活可导致肺动脉高压。PHD2主要是作用于HIF-2α而不是HIF-1α,原因是HIF-2α可以增加血管收缩内皮素1和减少血管舒张受体信号,加剧肺动脉高压。
4.4 红细胞生成素受体信号 有研究报道,红细胞生成素受体激活JAK2-STAT5信号转导瀑布,红细胞的生成依靠红细胞生成素的聚集,而红细胞生成素的聚集受PHD2-HIF-2α-VHL通路的调节[35]。红细胞生成素受体在Pro419和Pro426细胞质区域被PHD3羟基化,Pro419主要是下调VHL调节区,缺氧或者抑制PHD3导致红细胞生成素受体及下游基因的异常表达。然而,这些红细胞生成素受体在细胞膜积累与家族性和先天性红细胞增多有关,可能是缺乏Pro419导致PHD3-VHL调节下降。还需要更多的证据进一步证明[36]。
众所周知,PHD不仅作为氧感受器,还可对HIF通路进行调节。可激活一系列靶基因,主要在代谢、细胞转运、基因表达和细胞凋亡方面起着重要的作用,但具体机理尚未明确,仍需要我们进一步研究。本文通过总结PHD的各种调节机理及信号通路,为了解PHD的功能及研发针对靶点的新药物提供依据,为相关疾病的治疗提供新的思路。
参考文献:
[1]DENNY W A. Giving anemia a boost with inhibitors of prolyl hydroxylase[J]. J Med Chem, 2012, 55(7): 2943-2944.
[2]BOTUSAN I R, SUNKARI V G, SAVU O, et al. Stabilization of HIF-1alpha is critical to improve wound healing in diabetic mice[J]. Proc Natl Acad Sci U S A, 2008, 105(49): 19426-19431.
[3]HYV RINEN J, HASSINEN I E, SORMUNEN R, et al. Hearts of hypoxia-inducible factor prolyl 4-hydroxylase-2 hypomorphic mice show protection against acute ischemia-reperfusion injury[J]. J Biol Chem, 2010, 285(18): 13646-13657.
RINEN J, HASSINEN I E, SORMUNEN R, et al. Hearts of hypoxia-inducible factor prolyl 4-hydroxylase-2 hypomorphic mice show protection against acute ischemia-reperfusion injury[J]. J Biol Chem, 2010, 285(18): 13646-13657.
[4]FAN L H, LI J, YU Z F, et al. The hypoxia-inducible factor pathway, prolyl hydroxylase domain protein inhibitors, and their roles in bone repair and regeneration[J]. Biomed Res Int, 2014(7): 85-117.
[5]IRWIN R, LAPRES J J, KINSER S, et al. Prolyl-hydroxylase inhibition and HIF activation in osteoblasts promotes an adipocytic phenotype[J]. J Cell Biochem, 2007, 100(3): 762-772.
[6]NAKAYAMA K, FREW I J, HAGENSEN M, et al. Siah2 regulates stability of prolyl-hydroxylases, controls HIF1alpha abundance, and modulates physiological responses to hypoxia[J]. Cell, 2004, 117(7): 941-952.
[7]NGUYEN T L, DUR N R V. Prolyl hydroxylase domain enzymes and their role in cell signaling and cancer metabolism[J]. Int J Biochem Cell Biol, 2016, 80: 71-80.
N R V. Prolyl hydroxylase domain enzymes and their role in cell signaling and cancer metabolism[J]. Int J Biochem Cell Biol, 2016, 80: 71-80.
[8]LONGBOTHAM J E, LEVY C, JOHANNISSEN L O, et al. Structure and mechanism of a viral collagen prolyl hydroxylase[J]. Biochemistry, 2015, 54(39): 6093-6105.
[9] MACKENZIE D, SELAK M A, TENNANT D A, et al. Cell-permeating-ketoglutarate derivatives alleviate pseudohypoxia in succinate dehydrogenase-deficient cells[J]. Mol Cell Biol, 2017, 27:3282-3289.
[10]DALLATU M K, CHOI M, OYEKAN A O. Inhibition of prolyl hydroxylase domain-containing protein on hypertension/renal injury induced by high salt diet and nitric oxide withdrawal[J]. J Hypertens, 2013, 31(10): 2043-2049.
[11]LEE G, WON H S, LEE Y M, et al. Oxidative dimerization of PHD2 is responsible for its inactivation and contributes to metabolic reprogramming via HIF-1α activation[J]. Sci Rep, 2016, 6(1): 18928.
[12]DUR N R V, MACKENZIE E D, BOULAHBEL H, et al. HIF-independent role of prolyl hydroxylases in the cellular response to amino acids[J]. Oncogene, 2013, 32(38): 4549-4556.
N R V, MACKENZIE E D, BOULAHBEL H, et al. HIF-independent role of prolyl hydroxylases in the cellular response to amino acids[J]. Oncogene, 2013, 32(38): 4549-4556.
[13]EPSTEIN A R, GLEADLE J M, MCNEILL L A, et al.C.elegansEGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation[J]. Cell, 2001, 107(1): 43-54.
[14]SIEGERT I, SCHÖDEL J, NAIRZ M, et al. Ferritin-mediated iron sequestration stabilizes hypoxia-inducible factor-1α upon LPS activation in the presence of ample oxygen[J]. Cell Rep, 2015, 13(10): 2048-2055.
[15]HUANG J, ZHAO Q, MOONEY S M, et al. Sequence determinants in hypoxia-inducible factor-1alpha for hydroxylation by the prolyl hydroxylases PHD1, PHD2, and PHD3[J]. J Biol Chem, 2002, 277(42): 39792-39800.
[16]MILES A L, BURR S P, GRICE G L, et al. The vacuolar-ATPase complex and assembly factors, TMEM199 and CCDC115, control HIF1α prolyl hydroxylation by regulating cellular Iron levels[J]. Elife, 2017, 6: e22693.
[17]RAJAGOPALAN S, RANE A, CHINTA S J, et al. Regulation of ATP13A2 via PHD2-HIF1α signaling is critical for cellular iron homeostasis: implications for Parkinson’s disease[J]. J Neurosci, 2016, 36(4): 1086-1095.
[18]MILES S L, FISCHER A P, JOSHI S J, et al. Ascorbic acid and ascorbate-2-phosphate decrease HIF activity and malignant properties of human melanoma cells[J]. BMC Cancer, 2015, 15(1): 867.
[19]XING W, POURTEYMOOR S, MOHAN S. Ascorbic acid regulates osterix expression in osteoblasts by activation of prolyl hydroxylase and ubiquitination-mediated proteosomal degradation pathway[J]. Physiol Genomics, 2011, 43(12): 749-757.
[20]GUENTSCH A, BENEKE A, SWAIN L, et al. PHD2 is a regulator for glycolytic reprogramming in macrophages[J]. Mol Cell Biol, 2017, 37(1): 00216-00236.
[21]HENDERSON B, BITENSKY L, CHAYEN J. Glycolytic activity in human synovial lining cells in rheumatoid arthritis[J]. Ann Rheum Dis, 1979, 38(1): 63-67.
[22]YANG X Y, ZHENG K D, LIN K, et al. Energy metabolism disorder as a contributing factor of rheumatoid arthritis: a comparative proteomic and metabolomic study[J]. PLoS One, 2015, 10(7): e0132695.
[23]SERRA-PÉREZ A, PLANAS A M, N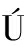
 EZ-O’MARA A, et al. Extended ischemia prevents HIF1alpha degradation at reoxygenation by impairing prolyl-hydroxylation: role of Krebs cycle metabolites[J]. J Biol Chem, 2010, 285(24): 18217-18224.
EZ-O’MARA A, et al. Extended ischemia prevents HIF1alpha degradation at reoxygenation by impairing prolyl-hydroxylation: role of Krebs cycle metabolites[J]. J Biol Chem, 2010, 285(24): 18217-18224.
[24]N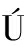
 EZ-O’MARA A, GERPE-PITA A, POZO S, et al. PHD3-SUMO conjugation represses HIF1 transcriptional activity independently of PHD3 catalytic activity[J]. J Cell Sci, 2015, 128(1): 40-49.
EZ-O’MARA A, GERPE-PITA A, POZO S, et al. PHD3-SUMO conjugation represses HIF1 transcriptional activity independently of PHD3 catalytic activity[J]. J Cell Sci, 2015, 128(1): 40-49.
[25]TAKEDA K, ICHIKI T, NARABAYASHI E, et al. Inhibition of prolyl hydroxylase domain-containing protein suppressed lipopolysaccharide-induced TNF-alpha expression[J]. Arterioscler Thromb Vasc Biol, 2009, 29(12): 2132-2137.
[26]ZHDANOV A V, OKKELMAN I A, COLLINS F W, et al. A novel effect of DMOG on cell metabolism: direct inhibition of mitochondrial function precedes HIF target gene expression[J]. Biochim Biophys Acta, 2015, 1847(10): 1254-1266.
[27]QUAEGEBEUR A, SEGURA I, SCHMIEDER R, et al. Deletion or inhibition of the oxygen sensor PHD1 protects against ischemic stroke via reprogramming of neuronal metabolism[J]. Cell Metab, 2016, 23(2): 280-291.
[28]MARTI H H, KUNZE R. Oxygen sensors and neuronal adaptation to ischemia[J]. Oncotarget, 2017, 8(2): 1955-1956.
[29]DUR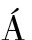 N R V, OPPLIGER W, ROBITAILLE A M, et al. Glutaminolysis activates Rag-mTORC1 signaling[J]. Mol Cell, 2012, 47(3): 349-358.
N R V, OPPLIGER W, ROBITAILLE A M, et al. Glutaminolysis activates Rag-mTORC1 signaling[J]. Mol Cell, 2012, 47(3): 349-358.
[30]BAR-PELED L, SCHWEITZER L D, ZONCU R, et al. Ragulator is a GEF for the rag GTPases that signal amino acid levels to mTORC1[J]. Cell, 2012, 150(6): 1196-1208.
[31]SCHOLZ C C, CAVADAS M A, TAMBUWALA M M, et al. Regulation of IL-1β-induced NF-κB by hydroxylases links key hypoxic and inflammatory signaling pathways[J]. Proc Natl Acad Sci U S A, 2013, 110(46): 18490-18495.
[32]LI J, YUAN W, JIANG S, et al. Prolyl-4-hydroxylase domain protein 2 controls NF-κB/p65 transactivation and enhances the catabolic effects of inflammatory cytokines on cells of the nucleus pulposus[J]. J Biol Chem, 2015, 290(11): 7195-7207.
[33]MATSUURA H, ICHIKI T, IKEDA J, et al. Inhibition of prolyl hydroxylase domain-containing protein down regulates vascular angiotensin Ⅱ type 1 receptor[J]. Hypertension, 2011, 58(3): 386-393.
[34]KAPITSINOU P P, RAJENDRAN G, ASTLEFORD L, et al. The endothelial prolyl-4-hydroxylase domain 2/hypoxia-inducible factor 2 axis regulates pulmonary artery pressure in mice[J]. Mol Cell Biol, 2016, 36(10): 1584-1594.
[35]KAPITSINOU P P, LIU Q, UNGER T L, et al. Hepatic HIF-2 regulates erythropoietic responses to hypoxia in renal anemia[J]. Blood, 2010, 116(16): 3039-3048.
[36]HEIR P, SRIKUMAR T, BIKOPOULOS G, et al. Oxygen-dependent regulation of erythropoietin receptor turnover and signaling[J]. J Biol Chem, 2016, 291(14): 7357-7372.
【中图分类号】R329.2+6
【文献标识码】A
DOI:10.11851/j.issn.1673-1557.2017.05.027
优先数字出版地址:http://kns.cnki.net/kcms/detail/51.1688.R.20170914.1646.030.html
(收稿日期:2017-06-05)
基金项目:青海省科技创新能力促进计划项目(编号2015-HZ-810)
通信作者:苏娟, sujuanqh@163.com