生酮饮食治疗儿童难治性癫痫的研究进展
乐 格,莫亚雄
(昆明医科大学第一附属医院,云南 昆明 650000)
【摘要】儿童难治性癫痫(refractory epilepsy,RE)也称药物RE,至今其定义没有明确标准,癫痫患者中约20%将成为RE。国内诊断标准是患儿服用2种以上的抗癫痫药物,而且治疗6个月,发作率仍>50%。国外早就应用生酮饮食(KD)来治疗儿童RE,且其临床疗效也得到了肯定,但其机理至今尚不清楚。KD治疗中出现的不良反应,大多可以积极预防和经对症处理缓解。
【关键词】生酮饮食;难治性癫痫;疗效
癫痫是神经系统常见病,2014年国际抗癫痫联盟(ILAE)提出,癫痫是由下列任何一个条件定义的脑部疾病:(1)至少2次非诱发性(或反射性)痫性发作,间隔时间>24 h;(2)一次非诱发性(或反射性)痫性发作,以及2次非诱发性痫性发作后10年内具有再次出现类似的痫性发作的可能性(至少60%);(3)诊断为癫痫综合征。大多数医生引用这一定义诊断癫痫[1]。儿童难治性癫痫(refractory epilepsy,RE)即常说的药物RE,是指服用2种以上抗癫痫药物,癫痫发作次数仍>50%[2-3]。RE是由癫痫患儿中约20%发展而来[4]。迄今RE的诊治包含:药物治疗、手术治疗、刺激术治疗、干细胞治疗、酮饮食疗法等。近些年,许多新的抗癫痫药物(antiepileptic drugs,AEDs)问世,如托吡酯、奥卡西平、拉莫三嗪等,多数患儿癫痫发作用这些药物容易控制,但仍有部分未能完全控制。当正确选用药物仍难以控制癫痫发作时,大多数抗癫痫专家会考虑将手术作为下一个治疗方案,但大部分患儿要么不适合手术,要么家长考虑手术风险太大不愿意手术。其他几种治疗方案效果因人而异,而且有些治疗费用高、治疗技术要求高,不适于大部分普通癫痫儿童家庭,因此国外很早就有用生酮饮食(ketogenic diet,KD)疗法治疗儿童RE的尝试。Wilder最早于1921年研究KD疗法,模仿饥饿时脂肪酸代谢产生酮体,酮体可以给机体提供能量,报告并证实KD疗法对RE有确切的疗效。目前许多研究也论证了KD治疗RE的有效性。KD是一种特殊配方饮食,含高脂肪、低糖类、适量蛋白质。而糖类、蛋白质和脂肪是人体主要的能源物质,其中糖类占主要成分。KD使机体的能量供应转化为以脂肪为主,脂肪所供能量约为总能量的90%,蛋白质和糖类所供能量约为总能量的10%。正因为KD的这种特殊食物配比,临床实施中难免遇到有一定的困难和阻碍,再加上许多新的AEDs出现,临床医师首先考虑使用AEDs治疗癫痫,KD的临床应用逐渐减少。近年来,由于RE患者的数量增多,AEDs不良反应逐渐出现,临床医生又开始关注KD。至今,KD疗法已被70多个国家采用[5],我国亦逐渐开展[6]。
1 生酮饮食用于治疗RE
1.1 生酮饮食的分类[7](1)经典的KD:脂肪∶(蛋白质+碳水化合物)两者的质量比=4∶1,如该饮食脂肪含4 g,就含l g(蛋白质+碳水化合物),这种配比多用于儿童;3∶1配方应用于婴儿。(2)中链三酰甘油(medium chain triglyceride,MCT)饮食:脂肪以MCT为主,能量60%来自MCT,MCT更易产生酮体,曾用于儿童及青少年,但对部分患儿可产生胃肠道刺激而出现呕吐、腹泻、肠痉挛等。后又出现改良的MCT,能量30%来自MCT,40%来自LCT。(3)改良的阿特金斯饮食(modified Atkins diet,MAD):通过降低脂肪比例也可以很好地控制癫痫,生酮比例起始为1~2∶1,然后观察癫痫发作状况,调整食物比例,无需限制热量和精确食物量比。由于它更易耐受和实施,所以很有发展前景。(4)低血糖指数治疗(low glycemic index treatment,LGIT):这种饮食是按热量比例分配,脂肪提供的热量占总的60%,蛋白质和碳水化合物提供的热量占总的20%~30%,其质量比约为1∶1,碳水化合物的总量有一定限制,并且只选择摄入升糖指数(glycemic index,GI)低于50的食物,如扁豆、柚、黄瓜等,补充维生素和矿物质等。
举例说明:10岁男孩RE患者,体质量28 kg,身高145 cm,每日所需总热量为8373.60 kJ,采用不同的KD 对应的食谱亦不同(详见表1)。应根据不同食材成分设计菜谱(详见表2)。
表1 不同生酮饮食对应的食谱
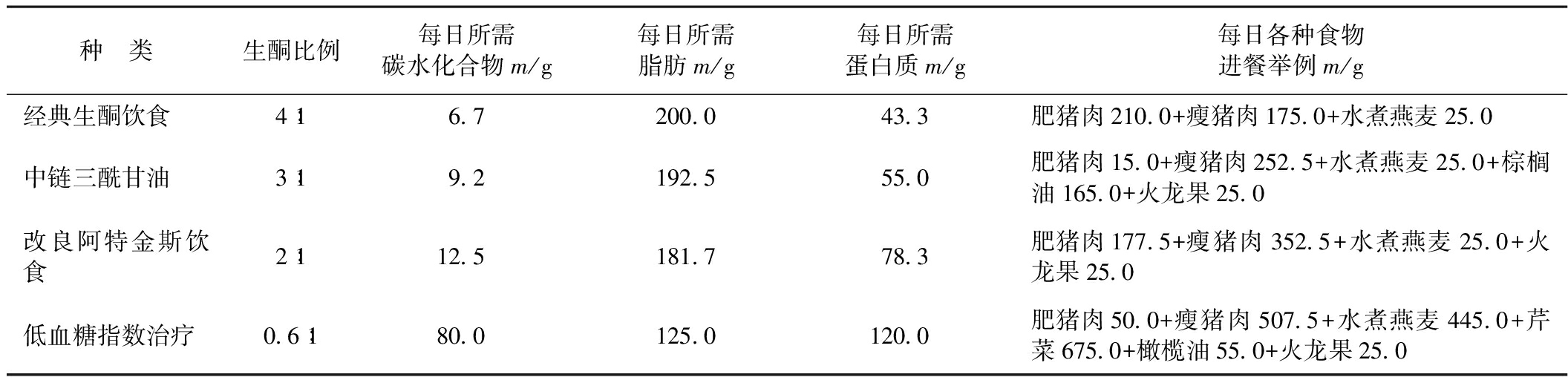
种 类生酮比例每日所需碳水化合物m/g每日所需脂肪m/g每日所需蛋白质m/g每日各种食物进餐举例m/g经典生酮饮食4∶1672000433肥猪肉2100+瘦猪肉1750+水煮燕麦250中链三酰甘油3∶1921925550肥猪肉150+瘦猪肉2525+水煮燕麦250+棕榈油1650+火龙果250改良阿特金斯饮食2∶11251817783肥猪肉1775+瘦猪肉3525+水煮燕麦250+火龙果250低血糖指数治疗06∶180012501200肥猪肉500+瘦猪肉5075+水煮燕麦4450+芹菜6750+橄榄油550+火龙果250
表2 几种食物成分表
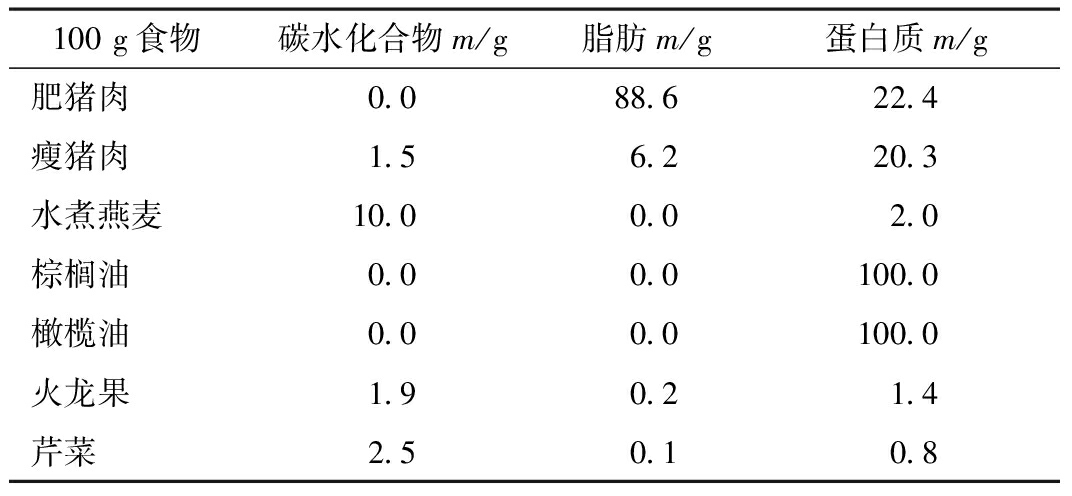
100g食物碳水化合物m/g脂肪m/g蛋白质m/g肥猪肉00886224瘦猪肉1562203水煮燕麦1000020棕榈油00001000橄榄油00001000火龙果190214芹菜250108
计算饮食:1个单位4∶1的经典的KD包含有4 g 脂肪、1 g 蛋白质与碳水化合物;1 g 脂肪产生37.68 kJ热量(37.68×4=150.72 kJ),1 g 蛋白质和碳水化合物产生16.75 kJ热量,1个单位4∶1饮食有150.72+16.75=167.47 kJ,热量的数值和饮食单位的分配依生酮比例的不同而不同。举例:总热量是8373.60 kJ,其所需每日的饮食单位数量是50个。脂肪需要量为50×4=200 g/d。蛋白质和碳水化合物需要量50×1=50 g/d。然后将每天所需总的脂肪、蛋白质和碳水化合物合理分配到三餐中,可以按表2来分配。
1.2 生酮饮食作用机理 KD作用机理尚不十分明确,其抗癫痫作用不同于AEDs[8],其可能机理如下。(1)KD通过酮体发挥抗癫痫作用:KD增加了脂肪的摄入,脂肪代谢分解产生酮体,酮体减少癫痫发作。最早在1930年有实验证实给点燃的大鼠腹腔注射乙酰乙酸可以抑制癫痫发作[9]。Dravet综合征和热性惊厥的小鼠模型中,KD组癫痫控制良好,且β-羟丁酸水平高于对照组,提示酮体可能有抗癫痫作用[9]。有关数据表明,在大鼠模型中选用KD生酮比例为6∶1的高比例较经典4∶1 抗癫痫作用更好,而且不良反应不会增加,提示了酮体的重要性。酮体可直接抑制谷氨酸转运体,使谷氨酸的释放减少,降低神经元兴奋性,从而抑制谷氨酸能突触传递。酮体可激活线粒体ATP敏感的钾离子通道,ATP敏感钾通道(KATP)是受细胞内ATP浓度调节的内向整流。酮体还可增加KATP通道的活性,促进其开放钾通道。(2)KD 通过酮体以外的途径发挥抗癫痫作用:研究发现MAD和LGIT尽管产生酮体较少,仍然能和传统的KD一样产生相似的抗癫痫功效[10-12]。Coppola等[11]在15例11~22岁的RE患者中使用LGIT,平均随访1年以后发现6例癫发作减少75%~90%,2例癫痫发作减少50%,只有少数患者有一过性的血酮体出现,可见LGIT不增加酮体,仅降低血清葡萄糖水平,仍然有一定的抗癫痫功效。(3)KD通过减少碳水化合物的代谢发挥抗癫痫作用:KD中碳水化合物比例相对少,葡萄糖代谢也相对减少,也减少糖酵解,有研究者通过抑制糖酵解、减少葡萄糖代谢模拟KD的实验来证实其是否具有抗癫痫作用[13],结果发现2-脱氧-D葡萄糖(2-Deoxy-D-glucose,2DG)可以抑制糖酵解,使葡萄糖代谢减少,对抗癫痫的确有显著作用[14]。通过阻滞钾离子通道、兴奋g-氨基丁酸A受体、拮抗代谢型谷氨酸Ⅰ受体等途径诱发的癫痫均可被2DG 抑制。(4)KD可抑制哺乳类动物雷帕霉素靶蛋白(mTOR)通路:KD可通过抑制mTOR活性,从而抑制mTOR通路,发挥抗癫痫作用。(5)KD可增加脑内腺苷、激活A1受体(ADK):研究证实KD可降低ADK表达,使腺苷水平增加,并通过激活A1受体抑制癫痫发作[15]。腺苷也是神经保护剂,同时具有改善睡眠的作用,KD也具有类似的生理功能,可改善RE患者睡眠[16]。
1.3 生酮饮食适应证 (1)采用KD疗法治疗的疾病:主要有葡萄糖载体蛋白1(GLUT-1)缺陷症,丙酮酸脱氢酶缺陷症(PDHD)。其他疾病,如肥胖、肿瘤、各种急慢性炎症性疾病、急慢性髓损伤、孤独症、行为问题和老年病如帕金森病、肌萎缩侧索硬化症、阿尔茨海默病等,也可以尝试采用KD治疗。(2)尽早优先考虑KD的癫痫:肌阵挛-失张力癫痫(Doose综合征),婴儿痉挛症,节性硬化症,Dravet综合征,其他类型的癫痫,RE持续状态,部分线粒体病及代谢性疾病等。
1.4 生酮饮食禁忌证 KD的绝对禁忌证多为脂肪酸代谢障碍性疾病[17]:卟啉病、丙酮酸羟化酶缺乏症,肉(毒)碱缺乏症,中、长链3-羟酰辅酶A缺乏症,短、中、长链酰基脱氢酶缺乏症。这些疾病进食KD后会出现低酮性低血糖,抽搐,心肌或骨骼肌损伤,肝、肾功能异常等,严重的甚至会引起死亡。而相对禁忌证为:(1)家属不能配合者;(2)不能耐受高酮饮食的癫痫患儿;(3)适合手术治疗的癫痫患儿。
1.5 生酮饮食不良反应 国内外文献报道,KD总体上是安全、有效的。KD初期的不良反应有:胃肠道功能紊乱、急性胰腺炎、低蛋白血症、感染性疾病等,后期维持期出现:骨钙丢失、结石形成、生长发育迟缓等[18]。有研究报道,KD引起的代谢紊乱中,高尿酸血症发生率稍高于低蛋白血症,然后是低钙血症[19]。泌尿系结石发生概率小,通常不需要停止饮食,口服枸橼酸钾有助于防止结石形成,大大减少结石发生。但近期研究发现,KD不会对长期生长造成不良影响[20],也不会对骨矿物质含量及骨密度产生负面影响[21]。
总之,正如2008年Kossof等[22]在国际KD研究小组推荐报告中所述, KD的不良反应较少,大部分患儿不需要因此而终止KD。严重不良反应的发生率较低,但医师需要认识到这些潜在的风险,以便能够告诫父母和监测患儿,从而防止这些并发症出现。
1.6 生酮饮食的停止 一般来说,启动KD治疗癫痫3个月后如果失败,应考虑停止KD饮食;如果完全控制,可根据临床情况2年后停止,但是对于患有GLUT-1缺乏症和PDHD等疾病的患儿,有必要维持KD更长时间,而且根据难治性癫痫患者对治疗的个体化反应可以精确调节疗程。对于完全控制癫痫发作的患儿,应该根据其脑电图检查和临床资料,2~3个月逐步停止KD饮食。
2 生酮饮食治疗方案和疗效判定[23]
KD配制方案:根据患儿年龄和理想体质量,总热量约为推荐总量的70%~80%;脂肪与蛋白质和碳水化合物重量比为4∶1,婴儿或肥胖儿童脂肪比例可酌情降低,可为3∶1;总液体量建议低于生理需要量,年龄较小患儿也可不用严格限制液体量;KD治疗中应适当补充矿物质、维生素等。可根据Engel分级判定疗效:临床发作完全控制为Ⅰ级(无发作),发作次数减少≥75%为Ⅱ级(显效),发作次数减少50%~<75%为Ⅲ级(有效),发作次数减少<50%为Ⅳ级(无效)。总有效=Ⅰ级+Ⅱ级+Ⅲ级。
3 生酮饮食治疗儿童RE的有效性分析[23]
KD控制癫痫发作的有效性已被证明。系统性分析26项研究(927例癫痫KD治疗者),使用KD 6个月后达Ⅰ级占15.6%,Ⅱ级占33.0%[24]。中华医学会儿科学分会神经学组研究显示,KD治疗3个月、6个月、12个月达Ⅲ级及以上分别为37.4%、26.1%和20.4%[25]。浙江大学医学院附属儿童医院使用MEDLINE和Googleshcolar等检索工具,检索有关KD治疗癫痫的相关文献,使用广义倒方差模型估计KD有效性及其95%的可信区间。结果共有38 篇文献符合纳入标准,回顾性研究中,KD治疗癫痫的加权有效性在3个月为58.4%,66个月为42.8%,12个月为30.1%;前瞻性研究中,有效率在3个月为53.9%,6个月为53.2%,12个月为55.0%[26]。短期疗效(3个月)评估和长期随访大样本病例,均显示KD有较好疗效:50%的发作减少大于50%;30%的发作可以减少90%以上,其中约20%的癫痫患儿可以完全控制发作,且79%的病例停止KD治疗后疗效保持;发作减少后,许多患儿的认知功能得到了改善和提高。癫痫伴孤独症患者预后很差,KD可作为孤独症一种新的安全有效的治疗手段。一项成组研究结果显示,30例4~6岁的患儿中,18例患儿坚持KD治疗6个月,患儿孤独症专项评分中11%有明显改善,44%有改善,44%稍有改善,特别是2例较轻孤独症的患儿疗效更好[27]。1篇个案分析报告KD治疗1例伴癫痫的孤独症女童,随访数年,首先是患儿癫痫发作减少,EEG 3 Hz的尖慢波消失,恢复正常;其次是肥胖减轻,认知改善;最后是孤独症完全缓解,其专项评分从49降到17,智商(IQ)升到70[28]。KD对孤独症治疗需要更多的多中心临床研究。
4 生酮饮食治疗的依从性及其影响因素分析
中华医学会儿科学分会神经学组研究显示,KD治疗维持3个月、6个月、12个月保留率逐渐下降,分别为65.9%、44.8%和26.4%[25]。依从性差是保留率下降的主要原因。多种因素可影响依从性,如KD实施过程复杂烦琐;家长对KD缺乏了解,随意改变患儿饮食;擅自停用AEDs;甚至停止KD治疗;患儿拒食或消化道对KD不能耐受等。因此,为提高KD治疗的依从性,减少癫痫发作,医务人员有必要告知家长和患儿实施KD的必要性及紧迫性,使家长充分认识到KD治疗RE的有效性,尽早实施KD治疗,告知家长KD治疗每个环节中可能遇到的困难及问题,并积极采取应对措施,帮助家长树立KD治疗的信心;另外,客观评估患儿消化水平,建议选择适合个体化的KD产品,逐步过渡到全配餐的KD。
5 小 结
KD治疗儿童RE有确切疗效,但它特殊的食物配比,使许多家长和患儿难以坚持。因此,应加强医护人员与家长和患儿之间的沟通,帮助其解决治疗中遇到的困难和问题,使他们树立治疗的信心,提高治疗的依从性,从而减少癫痫发作。
参考文献:
[1]ROBERT S F, ACEVEDO C, ARZIMANOGLOU A, et al. ILAE official report: a practical clinical definition of epilepsy[J]. Epilepsia,2014,55(4):475.
[2]FARRELL K, WIRRELL E, WHITING S. The definition and prediction of intractable epilepsy in children[J]. Adv Neurol, 2006, 97: 435-442.
[3]KWAN P, ARZIMANOGLOU A, BERG A T, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies[J]. Epilepsia, 2010, 51(6): 1069-1077.
[4]ZUPEC-KANIA B A, SPELLMAN E. An overview of the ketogenic diet for pediatric epilepsy[J]. Nutr Clin Pract, 2008, 23(6): 589-596.
[5]KOSSOFF E H, MCGROGAN J R. Worldwide use of the ketogenic diet[J]. Epilepsia, 2005, 46(2): 280-289.
[6]中华医学会儿科分会神经学组生酮饮食疗法协作组.长期生酮饮食治疗儿童难治性癫痫的前瞻性多中心研究[J].中华儿科杂志,2013,51(4):276-282.
[7]DHAMIJA R, ECKERT S, WIN′ELL E. Ketogenic diet[J]. Can J Neurol Sci,2013,40(2): 158-167.
[8]DANIAL N N, HARTMAN A L, STAFSTROM C E, et al. How does the ketogenic diet work? Four potential mechanisms[J]. J Child Neurol, 2013, 28(8): 1027-1033.
[9]RHO J M, ANDERSON G D, DONEVAN S D, et al. Acetoacetate, acetone, and dibenzylamine(a contaminant in l-(+)-β-hydroxybutyrate)exhibit direct anticonvulsant actions in vivo[J]. Epilepsia, 2002, 43(4): 358-361.
[10]DUTTON S B,SAWYER N T,KALUME F,et al.Protective effect of the ketogenic diet in Scn1a mutant mice[J].Epilepsia, 2011, 52: 2050-2056.
[11]COPPOLA G, D′ANIELLO A, MESSANA T, et al. Low glycemic index diet in children and young adults with refractory epilepsy: first Italian experience[J]. Seizure, 2011, 20(7): 526-528.
[12]CHEN W, KOSSOFF E H. Long-term follow-up of children treated with the modified Atkins diet[J]. J Child Neurol, 2012, 27(6): 754-758.
[13]PFEIFER H H, THIELE E A. Low-glycemic-index treatment:a liberalized ketogenic diet for treatment of intractable epilepsy[J]. Neurology, 2005, 65(11): 1810-1812.
[14]STAFSTROM C E, ROOPRA A, SUTULA T P. Seizure suppression via glycolysis inhibition with 2-deoxy-D-glucose (2DG)[J]. Epilepsia, 2008, 49(8): 97-100.
[15]MASINO S A, LI T, THEOFILAS P, et al. A ketogenic diet suppresses seizures in mice through adenosine A1 receptors[J]. J Clin Invest, 2011, 1(21): 2679-2683.
[16]HALLBOOK T, LUNDGREN J, ROSEN I. Ketogenic diet improves sleep quality in children with therapy-resistant epilepsy[J]. Epilepsia, 2007, 48(1): 59-65.
[17]周水珍.生酮饮食治疗儿童难治性癫痫[J].中华实用儿科临床杂志,2013,28(12):883-885.
[18]GROESBECK D K, BLUML R M, KOSSOFF E H. Long-term use of the ketogenic diet in the treatment of epilepsy[J]. Dev Med Child Neurol, 2006, 48(12): 978-981.
[19]CARABALLO R, VACCAREZZA M, CERS SIMO R, et al. Long-term follow-up of the ketogenic diet for refractory epilepsy: multicenter Argentinean experience in 216 pediatric patients[J]. Seizure, 2011, 20(8): 640-645.
SIMO R, et al. Long-term follow-up of the ketogenic diet for refractory epilepsy: multicenter Argentinean experience in 216 pediatric patients[J]. Seizure, 2011, 20(8): 640-645.
[20]NUMIS A L, YELLEN M B, CHU-SHORE C J, et al. The relationship of ketosis and groth to the efficacy of the ketogenic diet in infantile spasms[J]. Epilepsy Res, 2011, 96(1): 172-175.
[21]BERTOLI S, TRENTANI C, FERRARIS C, et al. Long-term effects of a ketogenic diet on body composition and bone mineralization in GLUT-1 deficiency syndrome: a case series[J]. Nutrition, 2014, 30(6): 726-728.
[22]KOSSOFF E H, ZUPEC-KANIA B A, AMARK P E, et al. Optimal clinical management of children receiving the ketogenic diet: recommendations of the International Ketogenic Diet Study Group[J]. Epilepsia, 2009, 50(2): 304-317.
[23]拜世英.生酮饮食治疗儿童难治性癫痫的疗效和不良反应[J].临床儿科学杂志,2015,33(10):900-902.
[24]KEENE D L. A systematic review of the use of the ketogenic diet in childhood epilepsy[J]. Pediatr Neurol, 2006, 35(1): 1-5.
[25]中华医学会儿科学分会神经学组生酮饮食疗法协作组.长期生酮饮食治疗儿童难治性癫痫的前瞻性多中心研究[J].中华儿科杂志, 2013, 51(4): 276-282.
[26]李海峰.生酮饮食治疗癫痫有效性的Meta 分析[Z],2013:294.
[27]EVANGELIOU A, VLACHONIKOLIS I, MIHAILIDOU H, et al. Application of a ketogenic diet in children with autistic behavior: pilot study[J]. J Child Neurol, 2003, 18(2): 113-118.
[28]HERBERT M R, BUCKLEY J A. Autism and dietary therapy: case report and review of the literature[J]. Child Neural, 2013, 28(8): 975-982.
通信作者:乐格,1073563318@qq.com
【中图分类号】R742.1
【文献标识码】A
DOI:10.11851/j.issn.1673-1557.2017.04.003
优先数字出版地址:http://kns.cnki.net/kcms/detail/51.1688.R.20170720.0944.048.html
(收稿日期:2016-09-02)


 SIMO R, et al. Long-term follow-up of the ketogenic diet for refractory epilepsy: multicenter Argentinean experience in 216 pediatric patients[J]. Seizure, 2011, 20(8): 640-645.
SIMO R, et al. Long-term follow-up of the ketogenic diet for refractory epilepsy: multicenter Argentinean experience in 216 pediatric patients[J]. Seizure, 2011, 20(8): 640-645.