2型糖尿病非酒精性脂肪肝与尿白蛋白排泄率和肾小球滤过率的关系
段严雅1,刘 春2
(1.石河子大学,新疆 石河子 832000;2.石河子大学医学院第一附属医院 肾病科,新疆 石河子 832000)
【摘要】目的:探讨2型糖尿病(T2DM)患者非酒精性脂肪肝(NAFLD)与尿白蛋白排泄率(UAER)和肾小球滤过率(eGFR)的关系,并分析UAER的相关影响因素。方法:224例T2DM患者根据是否合并NAFLD分为2组,观察组131例合并NAFLD,对照组93例不合并NAFLD,比较2组患者年龄、糖尿病病程、高血压患病率、收缩压、舒张压、体质量指数、糖化血红蛋白、空腹C肽、空腹胰岛素、胰岛素抵抗、肝功能、肾功能、血脂、血糖、果糖胺、eGFR、UAER之间的差异,然后将有显著性差异的因素作为自变量,将UAER作为因变量进行多元Logistic回归分析。结果:观察组的BMI、谷丙转氨酶、谷草转氨酶、谷氨酰转肽酶、三酰甘油、低密度脂蛋白、胱抑素C高于对照组(P<0.05),而年龄、病程、高密度脂蛋白低于对照组(P<0.05);糖尿病肾病早期阶段,合并NAFLD患者eGFR高于对照组(P<0.05);T2DM合并NAFLD的患者发生蛋白尿的可能性大,高体质量指数、高空腹血糖、NAFLD是T2DM患者UAER增加的独立危险因素。结论:NAFLD是T2DM患者UAER增加的独立危险因素,早期T2DM肾病合并NAFLD患者有较高的eGFR水平,因此早期诊断和干预NAFLD有可能会预防糖尿病肾病的发生发展。
【关键词】非酒精性脂肪肝;糖尿病肾病;慢性肾脏病;尿白蛋白排泄率;肾小球滤过率
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)作为全国重要的公共卫生问题,近年来越来越多地受到人们的关注。NAFLD不仅是局限于肝脏的疾病,它还是一种多系统疾病,与心血管并发症、高尿酸血症、痛风、胆石病、结肠腺瘤性息肉、睡眠呼吸暂停以及多囊卵巢综合征等多种疾病密切相关,但其与慢性肾脏病(chronic kidney disease, CKD)关系的研究较少。本研究通过检测2型糖尿病(type 2 diabetes mellitus, T2DM)患者24 h尿微量白蛋白,计算尿白蛋白排泄率(UAER),收集患者肝脏的超声资料,初步探讨T2DM患者NAFLD与UAER和eGFR的关系及其相关影响因素,以明确NAFLD与糖尿病肾病(diabetic nephropathy, DN)的关系。
1 材料与方法
1.1 一般资料 选取2014年1月至2016年4月石河子大学医学院第一附属医院的224例T2DM患者为研究对象。均符合世界卫生组织1999年T2DM诊断标准,排除糖尿病急性并发症、入选前1个月发生急性心血管事件、感染、恶性肿瘤、其他系统严重疾病导致的肝功能障碍、原发性肾脏疾病和除2型糖尿病以外其他病因所致的继发性肾脏疾病等。根据2010年中华医学会肝病学分会酒精性肝病学组修订的《非酒精性脂肪肝性肝病诊疗指南》中关于NAFLD的相关诊断标准,将患者分为单纯T2DM的对照组和T2DM合并NAFLD的观察组。对照组93例,其中:男59例,女34例;平均年龄(61.78±10.95)岁;高血压患病率41.94%(39/93)。观察组131例,其中:男80例,女51例;平均年龄(56.72±11.01)岁;高血压患病率43.51%(57/131)。2组间的性别、年龄、高血压患病率无显著性差异。
1.2 方法 收集所有患者的性别、年龄、糖尿病病程、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)以及高血压病史等一般资料和实验室检查指标,包括谷丙转氨酶(ALT)、白蛋白(ALB)、球蛋白(G)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、尿素氮(BUN)、血清肌酐(Cr)、血尿酸(UA)、空腹血糖(FPG)、果糖胺(FMN)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、糖化血红蛋白(HbA1c)、空腹C肽、空腹胰岛素、24 h尿微量白蛋白。根据稳态模式评估法(HOMA)计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=空腹血糖×空腹胰岛素/22.5。eGFR采用MDRD公式计算[1],eGFR=186×[血Cr(mg/mL)]-1.154×[年龄(岁)]-0.203×(0.742,女性)。计算UAER(μg·min-1)=尿微量白蛋白浓度×24 h尿量/1440。UAER<20 μg·min-1为正常,20 μg·min-1≤UAER<200 μg·min-1为微量白蛋白尿,UAER≥200 μg·min-1为大量白蛋白尿,其为非正态的计量资料,取其自然对数正态化后(LNUAER)的数据进行分析。
1.3 统计学处理 所有数据用SPSS17.0分析软件进行统计分析。正态分布的计量资料以均数±标准差表示,非正态分布的计量资料取自然对数正态化后分析,对于无法转换的数据以中位数(四分位数间距)表示;正态分布的计量资料多组间比较采用方差分析,两两比较用t检验。率的比较用χ2检验,非正态分布的资料用非参数秩和检验,分类变量的多因素分析采用Logistic逐步回归分析法。
2 结 果
2.1 SBP和DBP 经秩和检验,对照组SBP的中位数为130(120,140)mmHg(括号内为四分位间距,下同),DBP的中位数为80(70,80)mmHg,观察组SBP的中位数为135(125,150)mmHg,DBP的中位数为80(78,85)mmHg,2组SBP无显著性差异(P>0.05),DBP间存在显著性差异(P<0.05)。
2.2 糖尿病病程和实验室检查指标 结果详见表1。
表1 2组患者的糖尿病病程和实验室检查指标比较

项 目对照组(n=93)观察组(n=131)糖尿病病程/年1332±5681) 1159±630 BMI/(kg·m-2)2469±3621) 2707±302 HbA1c/%904±2142) 894±156 ALTcB/(mmol·L-1)1346±5141) 2175±1081A/G141±0372) 140±030 ASTcB/(mmol·L-1)1509±3851) 1852±741 ALPcB/(mmol·L-1)7034±18352)7426±2046GGTcB/(mmol·L-1)1986±13331)3423±4811UAcB/(μmol·L-1)30026±86952)31174±8780FPGcB/(mmol·L-1)829±3271) 1023±376 FMNcB/(mmol·L-1)34938±95002)34014±6057TGcB/(mmol·L-1)171±1321) 287±335 TCcB/(mmol·L-1)473±1202) 469±167 LDLcB/(mmol·L-1)317±1051) 285±085 HDLcB/(mmol·L-1)108±0241) 094±026 CYSCcB/(mmol·L-1)107±0851) 085±031 LNUAER376±1542) 412±139 HOMA⁃IR263±2121) 476±367 eGFRcB/(mL·min-1·173m-2)9354±29491)10644±3237
注:1)与观察组比较P<0.05;2)与观察组比较P>0.05
由表1可见,对照组糖尿病病程及LDL、HDL、CYSC显著高于观察组(均P<0.05),BMI、ALT、AST、GGT、FPG、TG、HOMA-IR、eGFR显著低于观察组(均P<0.05),2组患者的高血压患病率、HbA1c、A/G、ALP、UA、FMN、TC、LNUAER间无显著性差异(均P>0.05)。
2.3 eGFR水平和UAER 对照组93例中异常UAER共55例,占59.14%;观察组131例中异常UAER共103例,占78.63%。观察组蛋白尿的发生率显著高于对照组(P<0.05)。eGFR水平和UAER的对应情况详见表2。
表2 2组患者eGFR水平比较
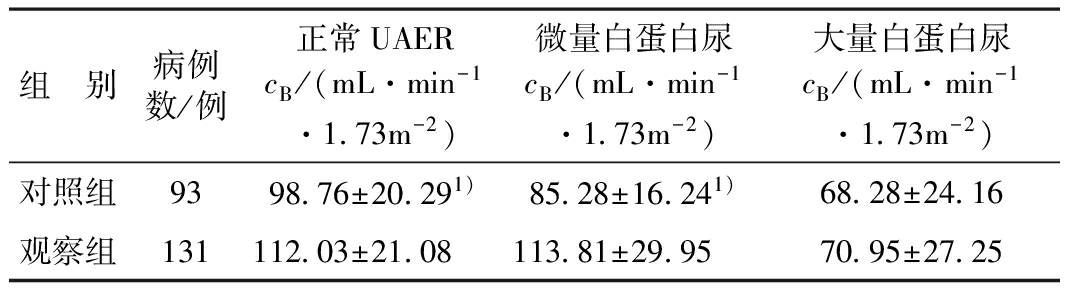
组 别病例数/例正常UAERcB/(mL·min-1·173m-2)微量白蛋白尿cB/(mL·min-1·173m-2)大量白蛋白尿cB/(mL·min-1·173m-2)对照组939876±20291)8528±16241)6828±2416观察组13111203±210811381±29957095±2725
注:1)与观察组比较P<0.05
根据年龄、糖尿病病程、高血压患病情况以及LNUAER等指标进行1∶1配比后,观察组在正常和微量白蛋白尿时eGFR水平明显高于对照组(P<0.05),而在大量白蛋白尿时2组eGFR水平无显著性差异(P>0.05)。
2.4 多因素Logistic回归分析 将有显著性差异的指标包括年龄≥60岁、糖尿病病程≥10年、BMI≥25 kg/m2、SBP≥140 mmHg、FPG≥7.0 mmol/L、HOMA-IR≥2.69、TC≥5.2 mmol/L、TG≥1.7 mmol/L、LDL≥1.2 mmol/L、HDL≥3.4 mmol/L、有无NAFLD、eGFR≥90 mL/(min·1.73m2)等12个研究因素的分类标准参照世界卫生组织规定的正常高值,其中HOMA-IR分类标准依据邢晓燕等[2]研究取值为>2.69为自变量,以是否发生尿蛋白结局变量(UAER≥20 μg·min-1为1,UAER<20 μg·min-1为0)为因变量,进行多因素非条件Logistic回归分析,采用进入法的似然比检验,结果显示高BMI(OR=2.682,95%CI1.291~5.570)、高空腹血糖(OR=2.302,95%CI1.113~4.762)、NAFLD(OR=2.248,95%CI1.076~4.699)是UAER增加的独立危险因素。
3 讨 论
NAFLD被定义为在排除过量饮酒或肝脏疾病的其他原因,包括自身免疫性、药物性以及病毒性肝炎等因素后,肝细胞中的脂肪含量仍大于5%的脂肪性肝病[3]。其病理学特征类似于酒精性肝损伤,但发生在无酗酒的患者中,其疾病谱包括单纯性脂肪肝、脂肪性肝炎、肝纤维化和肝硬化[4]。在我国,随着经济水平的提高和生活方式以及饮食结构的改变,NAFLD患病率亦呈逐年增长趋势且逐渐低龄化[5]。本研究显示T2DM患者NAFLD患病率高达58.48%,显著高于普通人群。
NAFLD是异位脂肪堆积在肝脏与慢性微炎症状态相结合的病理性表现。“二次打击假说”已成为解释NAFLD发病机理的最有吸引力的理论依据[6]。第一次打击是脂肪细胞在肝脏蓄积,这一过程与IR有关;第二次打击是与氧化应激和炎性细胞因子相关的损伤。因此,肝脏内异常细胞因子的产生可能在NAFLD的发病机理中起着重要的作用。本研究结果显示,合并NAFLD的T2DM患者具有明显的肥胖、肝细胞受损、胰岛素抵抗和糖脂代谢紊乱的特点,这与报道一致[7]。肝脏是糖、脂代谢调节的主要器官,是炎症因子的主要来源场所。NAFLD患者肝内脂肪堆积可以影响线粒体功能,产生活性氧自由基并激活内质网应激,使肝细胞凋亡从而导致肝损伤,受损的肝细胞对胰岛素的敏感性下降,从而导致胰岛素抵抗,同时肝细胞损伤可在较小的程度上释放ALT、AST以及炎症细胞因子如白介素-1β、白介素-6、瘦素和肿瘤坏死因子-α[8]。
NAFLD与CKD的关系也引起了许多科学家的兴趣。越来越多的证据表明,NAFLD可能增加CKD的风险,特别是T2DM患者。但NAFLD促进CKD发生发展的机理尚不明确,Jenks等[9]对933例60~74岁的T2DM患者进行了4年的随访,发现合并NAFLD患者eGFR每年下降的速度与未合并NAFLD患者组无显著性差异,提示NAFLD的存在与老年T2DM患者肾功能下降无关。Choudhary等[10]发现,NAFLD的存在不影响肾功能。但有学者认为NAFLD对eGFR的作用可能依赖于年龄因素[11]。总之,国内外学者关于NAFLD与CKD关系的研究结论尚不一致,其可能的原因是CKD患者蛋白尿的发生以及eGFR的改变受年龄、高血压病、糖尿病、感染以及心脏疾病等多种因素的影响。本研究的对象是排除感染、心力衰竭及急性心肌梗死等疾病后的T2DM患者,调整2组患者年龄、高血压患病率及糖尿病病程后比较eGFR水平,结果发现糖尿病肾病1~3期合并NAFLD组的eGFR高于未合并NAFLD组,而肾小球高灌注及高滤过是DN早期特征性的病理生理改变,因此NAFLD能够促进早期DN的进展,但其发病机理尚不明确。有研究表明肾素血管紧张素系统(RAS)在NAFLD和CKD的发病机理中起着关键性作用[12]。脂肪细胞能够表达RAS的所有成分,使循环中肾素、血管紧张素转换酶(ACE)和血管紧张素Ⅱ(Ang Ⅱ)增加30%[13]。肾脏和肝脏也表达RAS成分。在肝脏中,AngⅡ促进胰岛素抵抗、脂肪的合成以及促炎细胞因子的产生;在肾脏,RAS的激活通过AT1受体介导促进肾脏损害。AT1受体激活后,通过血流动力学作用增加血管张力,使血压升高,肾小球囊内压升高,相对收缩肾小球出球小动脉,进一步升高肾小球内压而使肾小球滤过率增加,促进肾脏病变进展。然而,对于糖尿病肾病4期及以上患者是否有这样的作用国内外报道较少见。而在本研究中,观察组与对照组在糖尿病肾病4期及以上患者的eGFR水平无显著差别,但是否因样本量相对较少以致出现假阴性结果,尚需扩大样本进一步研究。
众所周知,肥胖是CKD的独立危险因素,蛋白尿的发生与足细胞肥大和局灶性节段性肾小球的病理改变相关,即使不存在糖尿病和高血压的情况下,这种关系仍然存在[14]。越来越多的证据表明,NAFLD与CKD可能有共同的发病机理,如肥胖、腹型肥胖、胰岛素抵抗、高脂血症、高血压和炎症等,但关于两者之间的关系还需要进一步研究,以明确结论。本研究结果显示,NAFLD与T2DM患者的UAER增高有关,它是DN的独立危险因素。NAFLD可能通过血脂紊乱、系统性/肝外IR、血糖代谢障碍(增加肝糖原的产生)、RAS的激活以及许多潜在致病性介质(炎症标识物和全身释放促凝和促纤维化因子)等因素促进CKD发生发展,但在这些因素的复杂的盘根错节交互作用下,使得极难剖析出肝脏在NAFLD与CKD相关的危险因素中的作用及相关的作用机理。然而,最近由Musso等[13]发表的荟萃分析显示,NAFLD的存在和严重程度与CKD的风险增加和严重程度相关联。他们分析的主要结果是:(1)NAFLD与CKD的流行和发病率增加有关;(2)在NAFLD的肝脏疾病严重程度与发生CKD风险增加和严重性相关;(3)在糖尿病、非糖尿病患者以及在调整了传统的CKD的危险因素和独立于全身/腹部肥胖、IR后的研究中,这些关系仍有统计学差异。同时,Machado等[15]发现,NASH特别是小叶炎症和晚期纤维化,与轻微的eGFR下降有关,提示病态肥胖患者肝和肾脏损害之间存在共同的炎症因素。
NAFLD与CKD之间复杂的双向关系仍然不明确, 但这两种疾病有其共同的病理生理基础。早期干预T2DM患者NAFLD可延缓DN进入大量蛋白尿期,减少终末期肾脏病的患病率,提高T2DM患者的生存质量。
参考文献:
[1]LEVEY A S, BOSCH J P, LEWIS J B, et al. Modification of diet in renal disease study group.A more accurate method to estimate glomerular filtration rate from serum creatinine:a new prediction equation[J]. Ann Intern Med, 1999, 130(6): 461-470.
[2]邢晓燕,杨文英,杨兆军,等.胰岛素抵抗在不同糖耐量人群中诊断代谢综合征的作用[J].中华糖尿病杂志,2004,12(3):182-186.
[3]CHALASANI N, YOUNOSSI Z, LAVINE JE, et al. The diagnosis and management of non-alcoholic fatty liver disease: Practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association[J]. Hepatology, 2012, 55(6): 2005-2023.
[4]TARGHER G, MARRA F, MARCHESINI G. Increased risk of cardiovascular disease in non-alcoholic fatty liver disease: causal effect or epiphenomenon?[J]. Diabetologia, 2008, 51(11): 1947-1953.
[5]罗春华,李国静,周军,等.宜昌市职业人群非酒精性脂肪性肝病流行病学调查及其与代谢综合征相关性研究[J].重庆医学,2016,4(3):390-392.
[6]GEORGESCU F. Angiotensin receptor blockers in the treatment of NASH/NAFLD: could they be a first-class option?[J]. Adv Ther, 2008, 25(11): 1141-1174.
[7]MIKOLASEVIC I, ORLIC L, ZAPUTOVIC L, et al. Usefulness of liver test and controlled attenuation parameter in detection of nonalcoholic fatty liver disease in patients with chronic renal failure and coronary heart disease[J]. Wien Klin Wochenschr, 2015, 127(11/12): 451-458.
[8]CUSI K. Role of obesity andlipotoxicity in the development of nonalcoholic steatohepatitis: pathophysiology and clinical implications[J]. Gastroenterology, 2012, 142(4): 711-725.e6.
[9]JENKS J, CONWAY R, HOR J, et al. Hepatic steatosis and non-alcoholic fatty liver disease are not associated with decline in renal function in people with Type 2 diabetes[J]. Diabet Med, 2014, 31(9): 1039-1046.
[10]CHOUDHARY N S, SARAF N, KUMAR N, et al. Nonalcoholic fatty liver is not associated with incident chronic kidney disease:a large histology-based comparison with healthy individuals[J]. Eur J Gastroenterol Hepatol, 2016, 28(4): 441-443.
[11]SHEN Z, MUNKER S, LUO F G, et al. Effect of non-alcoholic fatty liver disease on estimated glomerular filtration rate could be dependent on age[J]. PLoS One, 2015, 10(6): e0130614.
[12]ORLIC L, MIKOLASEVIC I, LUKENDA V, et al. Nonalcoholic fatty liver disease and the renin-angiotensin system blockers in the patients with chronic kidney disease[J]. Wien Klin Wochenschr, 2015, 127(9/10): 355-362.
[13]MUSSO G, CASSADER M, COHNEY S, et al. Emerging liver-kidney interactions in nonalcoholic fatty liver disease[J]. Trends Mol Med, 2015, 21(10): 645-662.
[14]IX H, SHARMA K. Mechanisms linking obesity, chronic kidney disease, and fatty liver disease: the roles of fetuin-A, adiponectin, and AMPK[J]. J Am Soc Nephrol, 2010, 21(3): 406-412.
[15]MACHADO M V, Goncalves S, Carepa F, et al.Impaired renal function in morbid obese patients with nonalcoholic fatty liver disease[J]. Liver Int, 2012, 32(2): 241-248.
Relations of nonalcoholic fatty liver disease with urinary albumin excretion rate and glomerular filtration rate in patients with type 2 diabetes mellitus
DUAN Yanya1, LIU Chun2
(1. Shihezi University, Shihezi, Xinjiang 832000, China; 2. Department of Nephropathy,First Affiliated Hospital to Medical College of Shihezi University, Shihezi, Xinjiang 832000,China)
【Abstract】Objective: To investigate the relations between nonalcoholic fat liver disease (NAFLD) and urinary albumin excretion rate (UAER) and glomerular filtration rate(eGFR) in patients with type 2 diabetes mellitus(T2DM), and to analyze the influencing factors of UAER. Methods: 224 patients were divided into observation group (complicated with NAFLD, 131 cases) and control group (without NAFLD, 93 cases) .The age, duration of diabetes, morbidity of hypertension, SBP, DBP,BMI, HbA1c, fasting C peptide, fasting insulin and insulin resistance(HOMA-IR), liver function, renal function, blood lipids, blood glucose, fructosamine(FMN), eGFR and UAER were compared between the two groups. Then Logistic regression analysis was performed with taking the factors with statistically significant differences as independent variables, and the UAER as dependent variable. Results: The BMI, ALT,AST, GGT, TG, LDL and Cystatin C of the observation group were significantly higher than those of the control group(P<0.05); the age, duration of diabetes and HDL were significantly lower than those of the control group(P<0.05); the eGFR of patients complicated with NAFLD was significantly higher than that of the control group during the early stage of diabetic nephropathy(P<0.05); T2DM patients complicated with NAFLD had a higher probability of proteinuria;high BMI, high fasting glucose and NAFLD were independent risk factors for increased UAER in T2DM patients. Conclusion: NAFLD is an independent risk factor for increased UAER in T2DM patients. The early diagnosis and intervention of NAFLD may prevent the occurrence and development of diabetic nephropathy in T2DM patients.
【Keywords】nonalcoholic fatty liver disease; diabetic nephropathy; chronic kidney disease; urinary albumin excretion rate; glomerular filtration rate
通信作者:刘春,liuchun1966@163.com
【中图分类号】R587.1
【文献标识码】A
DOI:10.11851/j.issn.1673-1557.2017.02.006
优先数字出版地址:http://kns.cnki.net/kcms/detail/51.1688.R.20170306.1513.004.html
(收稿日期:2016-11-15)

