·综 述·
乳腺导管原位癌伴微浸润研究进展
郭 瑶,权 毅
(西南医科大学附属第一医院 乳腺外科,四川 泸州 646000)
【摘要】乳腺癌是威胁女性健康的第一位恶性肿瘤。随着筛查的开展、筛检技术的提高及人民健康意识的加强,导管原位癌(DCIS)和导管原位癌伴微浸润(DCIS-MI)的检出率显著增加。本文就国内外关于DCIS-MI的辅助检查、分子生物学特点及治疗的研究进展进行综述。
【关键词】乳腺癌;导管原位癌;微浸润;免疫组化;治疗
乳腺癌是威胁女性健康的第一位恶性肿瘤。随着筛查的开展、筛检技术的提高及人民健康意识的加强,导管原位癌(ductal carcinoma in situ, DCIS)和导管原位癌伴微浸润(ductal carcinoma in situ with microinvasion,DCIS-MI)的检出率显著增加。在新诊断的乳腺癌患者中,DCIS占20%~30%,DCIS-MI占5%~10%[1]。研究显示DCIS、DCIS-MI和浸润性导管癌(invasive ductal cancer,IDC)之间有着相同的基因表达,认为三者之间可能是一个连续的过程[2],DCIS-MI是DCIS发展到IDC的一个过渡阶段[3-4]。但是某些分子表达在三者之间存在着差异[5-8,3]。关于DCIS-MI的分子生物学特点及治疗方案选择已成为临床医生普遍关注的焦点。
1 关于定义
乳腺导管原位癌和浸润癌的定义有着明确的界定,但是微浸润癌的定义一直存在争议。美国癌症联合委员会(American Joint Committee on Cancer, AJCC)2010年版癌症分期指南中,将微浸润定义为癌细胞超过基底膜进入邻近组织,但没有病灶最大范围大于0.1 cm,当存在多灶微浸润时,以长径最大者为测量标准,并不是把各病灶的最大径加以总和,其临床分期为T1mic[9]。并进一步说明当存在多个微浸润灶时只有最大的病灶可以用于对浸润癌的分类。
2 检查和诊断
乳腺B超、乳腺钼靶、空心针穿刺及肿块切除活检是诊断乳腺疾病的常用检查方法。韩思佳等[10]认为DCIS-MI较单纯DCIS更易触及肿块。Yang等[11]研究表明DCIS-MI在影像学上更易发现肿块影,其中微钙化点伴肿块影占DCIS-MI的65%;与Leikola等[12]的研究结果相似。所以影像学表现为肿块影或微钙化伴肿块影时更易警惕是否有微浸润或浸润的存在。刘鹏等[13]认为乳腺钼靶诊断DCIS-MI较乳腺彩超与病检结果的符合率更高,建议将乳腺彩超和乳腺钼靶结合以减少此类疾病的漏诊。近年来随着磁共振成像(magnetic resonance imaging,MRI)动态增强扫描技术、功能与代谢成像和分子影像的新进展,使得乳腺癌MRI的敏感性和特异性大为提高。Velden等[14]发现乳腺MRI诊断DCIS-MI的特异度为83%,但Lee等[15]研究表明MRI诊断DCIS-MI仍具有明显的低估性。空心针穿刺为乳腺癌患者提供术前组织学诊断依据,有利于临床医生为患者拟定合理的治疗方案。但由于空心针穿刺取材较少,容易漏诊且对疾病存在低估现象。Schueller等[16]报告1352例超声引导的空心针穿刺结果,其假阴性为1.6%,组织学低估率为31.4%,与Mrsci等[17]研究结果相似。他们均提示空心针穿刺存在较高的假阴性率和低估率。
因此,就现有资料而言,对DCIS-MI尚无特异性的检查方法。目前的检查均存在对病变高估或低估的可能,DCIS-MI的诊断需依赖于整个肿块的切除活检。
3 免疫组化的差异
不同类型的乳腺癌分子分型存在差异,临床医生可根据肿瘤的分子分型选择个体化治疗方法。目前国内外关于DCIS-MI的ER、PR、HER-2的研究较多但是结论并不完全一致。有研究表明ER(+)、PR(+)较ER(-)、PR(-)无复发生存期较长[2],ER、PR在DCIS和DCIS-MI中的表达高于IDC[6]。但Okumura等[5]针对52例DCIS和28例DCIS-MI的研究却显示ER、PR的差异无统计学意义,结果同Zhang等[4]的研究相似。HER-2过表达被认为能够促进乳腺癌的侵袭和转移,它的过表达往往预示着不良的预后[7]。Mori等[18]研究证实HER-2在DCIS-MI中的表达高于DCIS,张良等[6]的研究也显示HER-2在DCIS、DCIS-MI和IDC中的表达率是逐渐升高的;相反, Zhang等[4]的研究却支持HER-2在单纯DCIS的阳性率大于DCIS-MI和IDC,与Liu等[19]的研究结果相似。
Ki-67是与细胞周期和增殖相关的基因蛋白,Ki-67高表达提示肿瘤生长活跃,容易发生转移[20],有研究提示Ki-67高表达往往和高核分级、p53(+)、HER-2过表达等预后不良指标相关[21]。Mori等[18]的研究发现Ki-67在DCIS-MI中的表达高于DCIS,与徐明等[22]的研究结果相同。
4 治 疗
4.1 手术治疗 对于DCIS-MI的手术方式主要为保乳手术或乳房切除术。DCIS-MI的原发灶的处理主要是确保手术切缘阴性[23]。研究表明,在保证DCIS-MI患者肿瘤切缘阴性的条件下接受乳房切除术和乳房肿瘤切除术+放疗的患者生存无差异[3]。但是关于DCIS-MI患者是否需行腋窝淋巴结清扫是有争议的[24]。目前主要存在两方面的观点:(1)由于腋淋巴结转移是影响预后的重要因素,伴淋巴结转移的患者肿瘤侵袭性较大;有学者认为DCIS-MI患者与DCIS患者相比具有更高的浸润能力[5],DCIS-MI的预后虽然较IDC好但与DCIS相比它的总体生存率和无病生存率较低[20],且DCIS-MI有潜在转移风险[3,8],DCIS-MI的淋巴结转移率为0%~14%,大于DCIS[8,24],所以他们更加倾向于对诊断DCIS-MI的患者应进行淋巴结活检,认为对DCIS-MI患者行淋巴结活检是有意义的。(2)另有学者认为DICS-MI和DCIS有着相似的自然病程[25,8],局部或远处转移的风险较低,单纯诊断为DCIS-MI不应该作为扩大手术范围的依据,且DCIS-MI的预后较IDC好[5],DCIS-MI患者不应行常规淋巴结清扫来确定分期[26,2,8]。随着前哨淋巴结活检(sentinel lymph node biopsy,SLNB)技术的开展,对DCIS-MI患者治疗也有了一定的指示作用。SLNB能反映腋窝淋巴结转移情况,可以指导分期和后续治疗,同时降低了腋窝淋巴结清扫术(axillary lymph node dissection,ALND)的并发症[3]。一项针对528例乳腺癌患者开展的对照试验提示SLNB的准确率可达98.5%,且进行SLNB与行ALND的患者局部复发无明显差异[26]。Zavagno等[8]对69例DCIS-MI患者行前哨淋巴结活检,发现9.4%的患者前哨淋巴结阳性,认为所有诊断为DCIS-MI的患者都应该进行前哨淋巴结活检[8],与Ma等[2]观点一致。前哨淋巴结活检对DCIS-MI患者的分期是有益的[19,24]。目前更倾向于对DCIS-MI行乳房切除或肿块切除的同时以SLNB的结果为依据决定患者是否需要行腋窝淋巴结清扫。
4.2 内分泌治疗及化疗 2015年NCCN指南推荐ER/PR(+)的乳腺癌患者使用内分泌治疗5年。ER(+)乳腺癌患者中辅助他莫昔芬治疗可减少39%复发率,减少31%死亡率[17];针对激素受体阳性的DCIS-MI患者建议予以辅助内分泌治疗[27,25]。但针对微浸润癌患者是否使用辅助化疗目前观点尚不一致。有学者认为微浸润不应该作为更积极治疗的唯一标准[25]。Isabelle等[28]主张将DCIS-MI分成2种类型:若病理显示仅为单一浸润性肿瘤细胞则为Ⅰ型,该型生物学特性同DCIS,治疗上应该与DCIS相同,不推荐使用全身化疗;若病理结果显示为成簇状的肿瘤细胞浸润则为Ⅱ型,该型预后较差,需要更积极的治疗。Tara等[3]认为若病理提示伴粉刺型或核分级高,这些患者往往局部复发风险增加而可考虑使用辅助化疗,与Parikh等[25]观点相同。腋窝淋巴结转移也是乳腺癌化疗选择的重要因素,腋窝淋巴结转移的患者复发风险相对较高,针对这类患者辅助以蒽环类为基础的6周期化疗可降低20%~30%的死亡率[29],推荐伴腋窝淋巴结转移的微浸润癌患者应辅以全身化疗。Reed等[30]也认为微浸润癌淋巴结活检为阳性时如激素受体为阳性则应予以内分泌治疗,若激素受体为阴性也应考虑予以全身辅助化疗,与Thürlimann等[31]观点一致。Kuhar等[27]建议对肿块直径大、激素受体阴性和HER-2过表达的患者予以全身辅助化疗。同肿瘤核分级、激素受体水平、淋巴结转移情况一样,年龄也是化疗与否的决策因素,Joerger等[29]认为50岁以下的患者是接受化疗的影响因素之一;Pagani等[32]也认为绝经后的ER(+)乳腺癌患者并不能通过化疗来提高其无病生存率,不推荐对绝经后的ER(+)患者予以全身辅助化疗。
随着21基因检测的开展,越来越多的学者推荐使用21基因检测得到的复发评分( recurrence score,RS)系统来评估患者预后及指导术后治疗。21基因由增殖相关基因(Ki-67、STK15、Survivin、CyclinB1和MYBL2)、表皮生长因子受体相关基因(GRB7、HER-2)、激素相关基因(ER、PgR、BCL2和SCUBE2)、浸润相关基因(Stromelysin3和Cathepsin L2)、3个未分类基因(GSTM1、CD68和BAG1)和5个参考基因(B-actin、GAPDH、RPLPO、GUS和TFRC)组成,通过检测21个基因的表达,将表达情况纳入评分公式[33]得到RS评分。RS评分预测乳腺癌的远处转移具有不依赖于患者年龄、淋巴结转移情况的优点[34]。Paik等[35]分析了RS评分和化疗的关系,显示辅助化疗与RS显著相关,RS≥31者即高复发风险组的化疗获益较大;RS<18者即低复发风险组其辅助化疗获益就微乎其微。Gianni等[36]研究也提示对于低RS评分的患者实施化疗获益率很低,对RS低评分者辅助化疗对降低复发风险无显著效果。所以,目前的临床对策是DCIS-MI患者可综合激素受体的表达、HER-2、淋巴结转移情况及RS评分结果来制定个体化的治疗方案。
4.3 靶向治疗 HER-2表达状态已经是影响临床医生对乳腺癌选择辅助治疗的重要因素。多数学者认为HER-2过表达IDC患者复发风险较高,应考虑予以靶向治疗[37],但DCIS-MI患者是否需要靶向治疗尚有争议。Curigliano等[38]认为HER-2过表达的高复发风险与激素受体状态无关,HER-2过表达在浸润灶中的表达提示着预后不佳,无论浸润灶的大小,认为DCIS-MI当HER-2在微浸润灶中过表达时应考虑使用靶向治疗[27]。但Burstein等[39]考虑化疗联合靶向治疗的获益与风险,则认为DCIS-MI不应联合使用靶向治疗。国内外针对早期乳腺癌是否需要靶向治疗的研究较多,2015年SABCS会议报道HERA研究Ⅲ期临床试验结果显示不管在T1a、T1b、T1c亚组中HER-2阳性乳腺癌使用靶向治疗均可使患者获益,改善预后,提高总的生存率[40],但尚缺乏针对DCIS-MI这一具体类型的相关临床试验。
5 预 后
deMascarel等[41]对722例DCIS、243例DCIS-MI和283例IDC患者中位随访7.3年,分析3组患者的临床、病理特性和预后情况,结果提示DCIS-MI患者的病理类型、肿瘤细胞分级与DCIS相似,淋巴结转移情况及预后介于DCIS和IDC二者之间。Tara等[3]研究对DCIS-MI、单纯的DCIS及不伴有淋巴结转移的浸润性癌做比较,DCIS-MI的生存率位于其余二者之间。Sánchez-Mu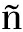 oz等[42]针对49例DICS-MI中位随访60个月得出DCIS-MI的总生存率为98%,无病生存率(DFS)为94%。但是不同DCIS-MI患者的预后也存在一定差异,肿瘤核分级高、存在粉刺样坏死、伴淋巴结转移患者的复发风险增高,预后相对较差[3,25,29];Estévez等[43]研究提示患者年龄小于50岁者其预后相对较差,与Joerger等[29]的结果相似。相同乳腺癌的分子生物学特点也与其预后有着密切的关系,Luminal A型预后较Luminal B型好,Luminal型预后较Basel-like型和HER-2过表达型好[44]。我们推测DCIS-MI的预后也与分子分型有着密切的关系,目前国内外尚缺乏关于DCIS-MI具体分子亚型预后的相关研究。但激素受体阴性、HER-2过表达、Ki-67高表达是影响DCIS-MI预后的重要因素[26]。
oz等[42]针对49例DICS-MI中位随访60个月得出DCIS-MI的总生存率为98%,无病生存率(DFS)为94%。但是不同DCIS-MI患者的预后也存在一定差异,肿瘤核分级高、存在粉刺样坏死、伴淋巴结转移患者的复发风险增高,预后相对较差[3,25,29];Estévez等[43]研究提示患者年龄小于50岁者其预后相对较差,与Joerger等[29]的结果相似。相同乳腺癌的分子生物学特点也与其预后有着密切的关系,Luminal A型预后较Luminal B型好,Luminal型预后较Basel-like型和HER-2过表达型好[44]。我们推测DCIS-MI的预后也与分子分型有着密切的关系,目前国内外尚缺乏关于DCIS-MI具体分子亚型预后的相关研究。但激素受体阴性、HER-2过表达、Ki-67高表达是影响DCIS-MI预后的重要因素[26]。
综上所述,DCIS-MI普遍被认为是介于DCIS和IDC之间的肿瘤,其可能是DCIS发展到IDC的过渡阶段,其生物学特性和预后也介于二者之间。术前对DCIS-MI尚无特异性的诊断方法。其手术方式主要有保乳手术或乳房切除术,且推荐使用前哨淋巴结活检来评估患者腋窝转移情况。推荐术后激素受体阳性的患者使用内分泌治疗5年,但是否行术后化疗、靶向治疗尚有争议,还需要更多的统一的、规范的临床研究以获得可靠的依据指导治疗。
参考文献:
[1]TANG P, HAJDU S I, LYMAN G H. Ductal carcinoma in situ: a review of recent advances[J]. Curr Opin Obstet Gynecol, 2007, 19(1): 63-67.
[2]MA X J, SALUNGA R, TUGGLE J T, et al. Gene expression profiles of human breast cancer progression[J]. Proc Natl Acad Sci U S A, 2003, 100(10): 5974-5979.
[3] TARA L,ADAMOVICH M D, RACHE M, et al.Ductal carcinoma in situ with microinvasion[J]. Retour Au Numéro, 2003,186(2):112-116.
[4]ZHANG W, GAO E L, ZHOU Y L, et al. Different distribution of breast ductal carcinoma in situ, ductal carcinoma in situ with microinvasion, and invasion breast cancer[J]. World J Surg Oncol, 2012, 10(1): 262.
[5]OKUMURA Y, YAMAMOTO Y, ZHANG Z, et al. Identification of biomarkers in ductal carcinoma in situ of the breast with microinvasion[J]. BMC Cancer, 2008, 8(4): 287.
[6]张良,孙圣荣,陈创,等.乳腺导管原位癌、微浸润癌及浸润性癌临床病理指标表达差异分析[J].临床外科杂志,2014(12):907-909, 913.
[7]S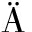 NGER N, ENGELS K, GRAF A, et al. Molecular markers as prognostic factors in DCIS and small invasive breast cancers[J]. Geburtshilfe Frauenheilkd, 2014, 74(11): 1016-1022.
NGER N, ENGELS K, GRAF A, et al. Molecular markers as prognostic factors in DCIS and small invasive breast cancers[J]. Geburtshilfe Frauenheilkd, 2014, 74(11): 1016-1022.
[8]ZAVAGNO G, BELARDINELLI V, MARCONATO R, et al. Sentinel lymph node metastasis from mammary ductal carcinoma in situ with microinvasion[J]. Breast, 2007, 16(2): 146-151.
[9]American Joint Committee on Cancer:Breast. In AJCC cancer staging manual[Z]. 7th ed, 2010: 417-460.
[10]韩思佳,张文海,赵罡,等.乳腺导管原位癌伴微浸润临床及影像学特点分析[J].山西医药杂志,2013,42(5):264-265.
[11]YANG M, MORIYA T, OGUMA M, et al. Microinvasive ductal carcinoma (T1mic) of the breast. The clinicopathological profile and immunohistochemical features of 28 cases[J]. Pathol Int, 2003, 53(7): 422-428.
[12]LEIKOLA J, HEIKKIL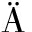 P, PAMILO M, et al. Predicting invasion in patients with DCIS in the preoperative percutaneous biopsy[J]. Acta Oncol, 2007, 46(6): 798-802.
P, PAMILO M, et al. Predicting invasion in patients with DCIS in the preoperative percutaneous biopsy[J]. Acta Oncol, 2007, 46(6): 798-802.
[13]刘鹏,杨德启,乔新民,等.乳腺钼靶和超声诊断乳腺原位癌伴早期浸润的对照研究[J].中国肿瘤临床,2007,34(1):48-51.
[14]VELDEN A D, BOETES C, BULT P, et al. The value of magnetic resonance imaging in diagnosis and size assessment of in situ and small invasive breast carcinoma[J]. Am J Surg, 2006, 192(2): 172-178.
[15]LEE J M, KAPLAN J B, MURRAY M P, et al. Underestimation of DCIS at MRI-guided vacuum-assisted breast biopsy[J]. AJR Am J Roentgenol, 2007, 189(2): 468-474.
[16]SCHUELLER G, JAROMI S, PONHOLD L, et al. US-guided 14-gauge core-needle breast biopsy: results of a validation study in 1352 cases[J]. Radiology, 2008, 248(2): 406-413.
[17]MRSCI M M, FRCSI E M, CECILY M F, et al. Predictors of invasive disease in breast cancer when core biopsy demonstrates DCIS only[J]. J Surg Oncol, 2006, 93(7): 559-563.
[18]MORI M, TSUGAWA K, YAMAUCHI H, et al. Pathological assessment of microinvasive carcinoma of the breast[J]. Breast Cancer, 2013, 20(4): 331-335.
[19]LIU C, ZHANG H, SHUANG C, et al. Alterations of ER, PR, HER-2/neu, and P53 protein expression in ductal breast carcinomas and clinical implications[J]. Med Oncol, 2010, 27(3): 747-752.
[20]POTEMSKI P, PLUCIENNIK E, BEDNAREK A K, et al. Ki-67 expression in operable breast cancer: a comparative study of immunostaining and a real-time RT-PCR assay[J]. Pathol Res Pract, 2006, 202(7): 491-495.
[21]SEYED-HAMID M, MEHRDAD P, MASOUD S, et al. The correlation between Ki67 with other prognostic factors in breast cancer: A study in Iranian patients[J].Indian Journal of Medical and Paediatric Oncology,2016,37(2):95-99.
[22]徐明,叶辉,叶曼娜,等.乳腺导管内癌伴微浸润的病理和免疫组织化学特征分析[J].中国临床医学,2015(2):224-227.
[23]ISAAC S S, STEPHEN L D, JESSICA R D, et al. Ductal carcinoma in situ(DCIS)of the breast:perspectives on biology and controversies in current management[J]. J Surg Oncol, 2012, 105(2): 212-220.
[24]CAVALIERE A, SCHEIBEL M, BELLEZZA G, et al. Ductal carcinoma in situ with microinvasion: clinicopathologic study and biopathologic profile[J]. Pathol Res Pract, 2006, 202(3): 131-135.
[25]PARIKH R R, HAFFTY B G, LANNIN D, et al. Ductal carcinoma in situ with microinvasion: prognostic implications, long-term outcomes, and role of axillary evaluation[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 7-13.
[26]王永胜,左文述,刘娟娟,等.乳腺癌前哨淋巴结活检替代腋窝清扫术前瞻性非随机对照临床研究[J].外科理论与实践,2006,11(2):104-107.
[27]KUHAR C G, MATOS E. Human epidermal growth factor receptor 2-positive microinvasive breast carcinoma with a highly aggressive course: a case report[J]. BMC Res Notes, 2014, 7(1): 325.
[28]ISABELLE D, MACGROGAN G, MATHOULIN-PÉLISSIER S, et al. Breast ductal carcinoma in situ with microinvasion[J]. Cancer, 2002, 94(8): 2134-2142.
[29]JOERGER M, THÜRLIMANN B, SAVIDAN A, et al. A population-based study on the implementation of treatment recommendations for chemotherapy in early breast cancer[J]. Clin Breast Cancer, 2012, 12(2): 102-109.
[30] REED J, ROSMAN M, VERBANAC K M,et al.Prognostic implications of isolated tumor cells and micrometastases in sentinel nodes of patients with invasive breast cancer: 10-year analysis of patients enrolled in the prospective East Carolina University/Anne Arundel Medical Center Sentinel Node Multicenter Study[J].J Am Coll Surg,2009, 208(3):333-340.
[31]THÜRLIMANN B, PRICE K N, GELBER R D, et al. Is chemotherapy necessary for premenopausal women with lower-risk node-positive, endocrine responsive breast cancer? 10-year update of International Breast Cancer Study Group Trial 11-93[J]. Breast Cancer Res Treat, 2009, 113(1): 137-144.
[32]PAGANI O, GELBER S, SIMONCINI E, et al. Is adjuvant chemotherapy of benefit for postmenopausal women who receive endocrine treatment for highly endocrine-responsive, node-positive breast cancer? International Breast Cancer Study Group Trials Ⅶ and 12-93[J]. Breast Cancer Res Treat, 2009, 116(3): 491-500.
[33]HABEL L A, SHAK S, JACOBS M K, et al. A population-based study of tumor gene expression and risk of breast cancer death among lymph node-negative patients[J]. Breast Cancer Res, 2006, 8(3): R25.
[34]ALBAIN K S, BARLOW W E, SHAK S, et al. Prognostic and predictive value of the 21-gene recurrence score assay in postmenopausal women with node-positive, oestrogen-receptor-positive breast cancer on chemotherapy: a retrospective analysis of a randomised trial[J]. Lancet Oncol, 2010, 11(1): 55-65.
[35]PAIK S, TANG G, SHAK S, et al. Gene expression and benefit of chemotherapy in women with node-negative, estrogen receptor-positive breast cancer[J]. J Clin Oncol, 2006, 24(23): 3726-3734.
[36]GIANNI L, ZAMBETTI M, CLARK K, et al. Gene expression profiles in paraffin-embedded core biopsy tissue predict response to chemotherapy in women with locally advanced breast cancer[J]. Journal of Clinical Oncology, 2005, 23(29): 7265-7277.
[37]IENI A, GIUFFR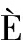 G, LANZAFAME S, et al. Morphological and biomolecular characteristics of subcentimetric invasive breast carcinomas in Sicily: a multicentre retrospective study in relation to trastuzumab treatment[J]. Oncol Lett, 2012, 3(1): 141-146.
G, LANZAFAME S, et al. Morphological and biomolecular characteristics of subcentimetric invasive breast carcinomas in Sicily: a multicentre retrospective study in relation to trastuzumab treatment[J]. Oncol Lett, 2012, 3(1): 141-146.
[38]CURIGLIANO G, VIALE G, BAGNARDI V, et al. Clinical relevance of HER2 overexpression/amplification in patients with small tumor size and node-negative breast cancer[J]. J Clin Oncol, 2009, 27(34): 5693-5699.
[39]BURSTEIN H J, WINER E P. Refining therapy for human epidermal growth factor receptor 2-positive breast cancer: T stands for trastuzumab, tumor size, and treatment strategy[J]. J Clin Oncol, 2009, 27(34): 5671-5673.
[40]JACKISCH C, PICCART M J, GELBER R D, et al. Abstract PD5-01: HERA trial: 10 years follow up of trastuzumab after adjuvant chemotherapy in HER2 positive early breast cancer-final analysis[J]. Cancer Research, 2016, 76(Suppl 4):PD5-01.
[41]deMASCAREL I, MacGROGAN G, MATHOULIN-PELISSIER S,et al.Breast ductal carcinoma in situ with microinvasion: a definition supported by a long-term study of 1248 serially sectioned ductal carcinomas[J].Cancer,2002,94(8):2134-2142.
[42]S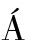 NCHEZ-MU
NCHEZ-MU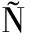 OZ A, PÉREZ-RUIZ E, JURADO J M, et al. Prognosis of microinvasive breast carcinoma with negative axillary nodes in accordance with TNM classification criteria[J]. Breast J, 2010, 16(6): 669-671.
OZ A, PÉREZ-RUIZ E, JURADO J M, et al. Prognosis of microinvasive breast carcinoma with negative axillary nodes in accordance with TNM classification criteria[J]. Breast J, 2010, 16(6): 669-671.
[43]ESTÉVEZ L G, ALVAREZ I, SEGU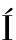 M
M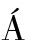 , et al. Current perspectives of treatment of ductal carcinoma in situ[J]. Cancer Treat Rev, 2010, 36(7): 507-517.
, et al. Current perspectives of treatment of ductal carcinoma in situ[J]. Cancer Treat Rev, 2010, 36(7): 507-517.
[44]KOBAYASHI T, IWAYA K, MORIYA T, et al. A simple immunohistochemical panel comprising 2 conventional markers, Ki67 and p53, is a powerful tool for predicting patient outcome in luminal-type breast cancer[J]. BMC Clin Pathol, 2013, 13(3): 5.
通信作者:权毅,yancheng1118@163.com
【中图分类号】R737.9
【文献标识码】A
DOI:10.11851/j.issn.1673-1557.2017.02.001
优先数字出版地址:http://kns.cnki.net/kcms/detail/51.1688.R.20170306.1532.028.html
(收稿日期:2016-05-30)
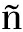 oz等[42]针对49例DICS-MI中位随访60个月得出DCIS-MI的总生存率为98%,无病生存率(DFS)为94%。但是不同DCIS-MI患者的预后也存在一定差异,肿瘤核分级高、存在粉刺样坏死、伴淋巴结转移患者的复发风险增高,预后相对较差[3,25,29];Estévez等[43]研究提示患者年龄小于50岁者其预后相对较差,与Joerger等[29]的结果相似。相同乳腺癌的分子生物学特点也与其预后有着密切的关系,Luminal A型预后较Luminal B型好,Luminal型预后较Basel-like型和HER-2过表达型好[44]。我们推测DCIS-MI的预后也与分子分型有着密切的关系,目前国内外尚缺乏关于DCIS-MI具体分子亚型预后的相关研究。但激素受体阴性、HER-2过表达、Ki-67高表达是影响DCIS-MI预后的重要因素[26]。
oz等[42]针对49例DICS-MI中位随访60个月得出DCIS-MI的总生存率为98%,无病生存率(DFS)为94%。但是不同DCIS-MI患者的预后也存在一定差异,肿瘤核分级高、存在粉刺样坏死、伴淋巴结转移患者的复发风险增高,预后相对较差[3,25,29];Estévez等[43]研究提示患者年龄小于50岁者其预后相对较差,与Joerger等[29]的结果相似。相同乳腺癌的分子生物学特点也与其预后有着密切的关系,Luminal A型预后较Luminal B型好,Luminal型预后较Basel-like型和HER-2过表达型好[44]。我们推测DCIS-MI的预后也与分子分型有着密切的关系,目前国内外尚缺乏关于DCIS-MI具体分子亚型预后的相关研究。但激素受体阴性、HER-2过表达、Ki-67高表达是影响DCIS-MI预后的重要因素[26]。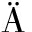 NGER N, ENGELS K, GRAF A, et al. Molecular markers as prognostic factors in DCIS and small invasive breast cancers[J]. Geburtshilfe Frauenheilkd, 2014, 74(11): 1016-1022.
NGER N, ENGELS K, GRAF A, et al. Molecular markers as prognostic factors in DCIS and small invasive breast cancers[J]. Geburtshilfe Frauenheilkd, 2014, 74(11): 1016-1022.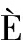 G, LANZAFAME S, et al. Morphological and biomolecular characteristics of subcentimetric invasive breast carcinomas in Sicily: a multicentre retrospective study in relation to trastuzumab treatment[J]. Oncol Lett, 2012, 3(1): 141-146.
G, LANZAFAME S, et al. Morphological and biomolecular characteristics of subcentimetric invasive breast carcinomas in Sicily: a multicentre retrospective study in relation to trastuzumab treatment[J]. Oncol Lett, 2012, 3(1): 141-146.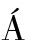 NCHEZ-MU
NCHEZ-MU OZ A, PÉREZ-RUIZ E, JURADO J M, et al. Prognosis of microinvasive breast carcinoma with negative axillary nodes in accordance with TNM classification criteria[J]. Breast J, 2010, 16(6): 669-671.
OZ A, PÉREZ-RUIZ E, JURADO J M, et al. Prognosis of microinvasive breast carcinoma with negative axillary nodes in accordance with TNM classification criteria[J]. Breast J, 2010, 16(6): 669-671. M
M